Articolo divulgativo in Chimica fisica di
Maria Antonietta Carpentieri Questo breve articolo ripercorre brevemente i passaggi storici e gli esperimenti fondamentali che hanno portato all’invenzione dello spettroscopio chiamato ‘Spettroscopio di Kirchhoff-Bunsen’, che ha portato alla nascita della spettroscopia. Il testo ha anche lo scopo di evidenziare il ruolo didattico di strumenti storici, che, come in questo caso, possono essere ancora utilizzati nei corsi di chimica sia a livello di scuola secondaria che di Università.
Questo breve articolo ripercorre brevemente i passaggi storici e gli esperimenti fondamentali che hanno portato all’invenzione dello spettroscopio chiamato ‘Spettroscopio di Kirchhoff-Bunsen’, che ha portato alla nascita della spettroscopia. Il testo ha anche lo scopo di evidenziare il ruolo didattico di strumenti storici, che, come in questo caso, possono essere ancora utilizzati nei corsi di chimica sia a livello di scuola secondaria che di Università.
Introduzione
In tutti i laboratori universitari e in quelli scolastici degli Istituti Tecnici Industriali di indirizzo chimico sono presenti una o più tipologie di spettrofotometri UV-Vis (Ultravioletto Visibile), IR (Infrarosso) o AAS (Assorbimento Atomico). Difficilmente negli stessi laboratori di chimica è presente un semplice spettroscopio didattico, quello che viene chiamato spettroscopio di Kirchhoff- Bunsen dal nome dei due scienziati che lo idearono nel 1859. Eppure la storia della Spettroscopia e dell’Analisi Chimica Strumentale inizia con questo spettroscopio, che dal 1860 in poi è stato utilizzato per l’identificazione di diversi nuovi elementi della tavola periodica e con il quale nasce l’Astrofisica e lo studio dal punto di vista chimico dei corpi celesti. Sebbene l’invenzione dello strumento sia associata ai due scienziati tedeschi lo schema di funzionamento dello strumento è frutto di 100 anni di investigazione e di un lento processo di “montaggio” dei componenti ottici nell’assemblamento finale. Singolare aspetto di questa storia è che un passaggio di fondamentale importanza per arrivare all’analisi spettrale è stata l’invenzione del becco Bunsen, il bruciatore presente in tutti i laboratori di chimica.
Passaggi storici significativi che precedono l’invenzione dello Spettroscopio di Kirchhoff-Bunsen
Il primo passo verso l’analisi spettrale è stato l’esame del colore impartito alla fiamma prodotta dalle sostanze. Già nel 1758, Andreas Sigismund Marggraf (1709-1782) notò il colore giallo della fiamma prodotto dai sali di sodio e il color violetto-lavanda dai sali di potassio,1 ma è solo nel 1801 che William Hyde Wollaston (1766-1828) esaminò lo spettro della luce emessa dalla fiamma di una candela attraverso un prisma.1 Wollaston iniziò a utilizzare fenditure abbastanza sottili attraverso cui far passare la luce da analizzare e così facendo riuscì a osservare 7 linee scure nello spettro solare.2 Nel 1814 Joseph Von Fraunhofer (1787-1826), un giovane ottico tedesco, mentre studiava gli indici di rifrazione di alcuni campioni di lenti per diversi colori, notò una doppia linea luminosa, quella del sodio, nella fiamma che stava utilizzando e successivamente ritrovò questa doppia linea in diversi tipi di fiamma.2 Per vedere se la stessa doppia linea potesse essere presente nello spettro solare fece passare la luce solare attraverso una sottile fenditura e poi attraverso una lente convessa3 su un prisma al di là del quale pose un telescopio, per osservare meglio la posizione angolare delle linee. Di fatto era stato così sviluppato un primo schema di spettroscopio: al posto della doppia linea brillante, nello spettro solare, von Fraunhofer osservò innumerevoli righe scure, circa 600. Classificò le più intense con le lettere maiuscole, dalla A, per quelle che cadevano nella regione del rosso, alla H, nel violetto.2 Durante la sua vita continuò a studiare queste linee che portano ancora il suo nome, senza però capirne l’origine. Nel 1821 von Fraunhofer realizzò nuovi esperimenti sullo spettro solare utilizzando un reticolo a trasmissione realizzato con fili montati su un telaio e un reticolo a riflessione realizzato praticando incisioni su un vetro ricoperto da uno strato di oro: in questo modo riuscì a misurare con precisione la lunghezza d’onda della linea ‘D’, che corrispondeva a quella della doppia linea brillante, osservata già in precedenza dagli altri scienziati.2 Nel 1822 l’astronomo britannico John Frederick William Herschel (1792-1871) riportò che la luce colorata emessa dalle fiamme dei cloruri di calcio, stronzio, bario e rame e dell’acido borico, fatta passare attraverso un prisma, produceva delle linee brillanti su uno sfondo nero. Herschel ritenne che queste linee brillanti potessero essere utili per rilevare piccole quantità di sostanze e queste conclusioni sono contenute nel suo “Treatise on light”:2 “The colours thus contributed by different objects to flame afford in many cases a ready and neat way of detecting extremely minute quantities of them”.3 Nel 1834 William Henry Fox Talbot (1800-1877), inventore e fotografo inglese, trovò che era possibile mediante un prisma distinguere i sali di litio da quelli di stronzio, che davano entrambi colorazione rossa alla fiamma, osservando la posizione precisa delle linee colorate osservate nello spettro.1,2 Sempre nel 1834, il fisico Sir David Brewster (1781-1868), dopo aver osservato lo spettro della luce solare che era stato fatto passare attraverso vapori di acido nitrico, parlò in suo report della scoperta di un principio generale di analisi secondo il quale le sostanze hanno un’azione su parti definite dello spettro. In linea con questo lavoro, John Frederic Daniell (1790-1845), l’inventore della Pila ‘Daniell’, e William Hallowes Miller (1801-1880), mineralogista e cristallografo inglese, esaminarono con un piccolo telescopio la luce di una lampada a gas fatta passare attraverso i vapori di alogeni.2 Nel 1835 Charles Wheatstone (1802-1875) notò che negli spettri della luce prodotta dagli archi elettrici le linee brillanti osservate erano caratteristiche del metallo di cui era fatto l’elettrodo.2 Queste osservazioni, avvenute quindi quasi contemporaneamente da parte di vari scienziati, anticiparono l’utilizzo analitico dell’analisi della luce emessa (o assorbita) dalle sostanze chimiche. Grandi risultati furono ottenuti infine nel 1849 dal fisico francese Jean Bernard Leon Foucault (1819-1869), famoso per il ‘pendolo di Foucault’, che, esaminando lo spettro della luce emessa da un arco elettrico tra due elettrodi di carbone, notò una linea ‘D’ nella regione del giallo, simile a quella dello spettro solare (Schema 1a). Foucault cercò di indagare meglio questo fenomeno. Tentò di sovrapporre lo spettro della luce solare (Schema 1b) a quello dell’arco, facendo passare la luce solare prima attraverso l’arco e poi analizzando la luce con il prisma (si veda lo Schema 1c). In questo modo dimostrò che la posizione delle due linee era identica, ma, diversamente da quanto atteso, la linea ‘D’ scura dello spettro solare diventava ancora più scura dopo il passaggio attraverso l’arco. Inoltre, se si oscurava la luce solare, la linea ‘D’ prodotta dall’arco ricompariva brillante.2
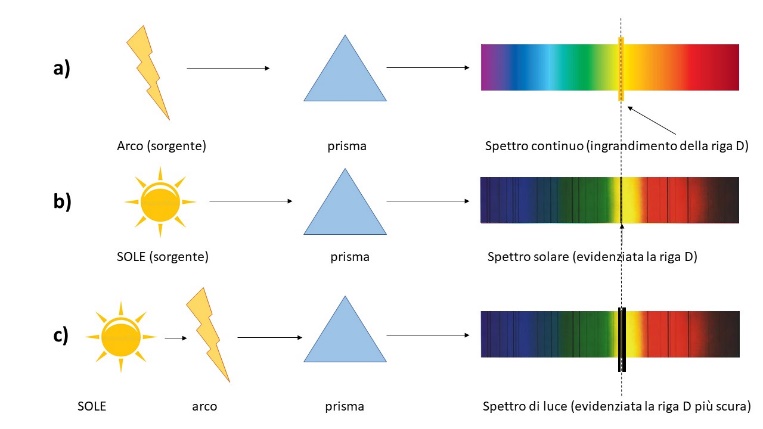 Schema 1. Schema che riproduce i vari esperimenti fatti da Foucault per dimostrare che la linea scura ‘D’ dello spettro della luce solare, già osservata da Fraunhofer, era la stessa che si osserva analizzando la luce prodotta da un arco incandescente, e che corrisponde, come dimostrato successivamente alla riga (doppia) caratteristica del sodio.
Schema 1. Schema che riproduce i vari esperimenti fatti da Foucault per dimostrare che la linea scura ‘D’ dello spettro della luce solare, già osservata da Fraunhofer, era la stessa che si osserva analizzando la luce prodotta da un arco incandescente, e che corrisponde, come dimostrato successivamente alla riga (doppia) caratteristica del sodio.
Fino a questo momento, tuttavia, non c’era stata una reale comprensione della relazione tra le linee brillanti emesse dalle fiamme (i.e. righe di emissione del sodio) e le linee scure dello spettro solare (i.e. righe di assorbimento del sodio). Questa mancata comprensione era dovuta anche a due limiti sperimentali di quel tempo: gli spettri ottenuti analizzando con il prisma le linee brillanti prodotte dalle varie sorgenti luminose, come l’arco di Foucault o le varie fiamme, non riuscivano ad essere completamente liberi dallo spettro continuo della luce bianca prodotta dalla fiamma stessa, che conteneva particelle carboniose incandescenti. Inoltre, sia le fiamme che gli archi elettrici utilizzati in questi esperimenti erano contaminati dal sodio per cui la riga ‘D’ compariva in tutte le analisi.2 I bruciatori utilizzati fino a quel momento, infatti, avevano il grave difetto di produrre fiamme luminose e fumose dal basso potere calorifico.
Innovazioni tecniche e il primo spettroscopio
L’idea di Robert Wilhelm Bunsen (1811-1899), chimico e fisico tedesco, fu quella di non alimentare la fiamma con l’aria dall’esterno, ma di preparare la miscela gas-aria prima del punto in cui si generava la combustione. In questo modo si riusciva ad ottenere una fiamma non luminosa dall’alto potere calorifico. Il nuovo bruciatore fu realizzato grazie al tecnico di laboratorio, assistente di Bunsen nel suo laboratorio di Heidelberg, Peter Desaga (1812-1879): era il 1855. Né Bunsen né Desaga depositarono il brevetto del nuovo bruciatore.4 Arriviamo così alla data del 1859: utilizzando il suo nuovo bruciatore Bunsen cercava di distinguere tra fiamme di colorazione simile di metalli diversi con l’uso di vetri o soluzioni colorate per l’analisi chimica e fu a questo punto che Gustav Robert Kirchhoff (1824-1887), che aveva raggiunto Bunsen all’Università di Heidelberg, gli suggerì di utilizzare un prisma per separare la luce proveniente dalla fiamma nei suoi raggi costituenti. Su questo principio i due svilupparono il primo spettroscopio che porta il loro nome. Lo spettroscopio quindi non utilizzava principi fino ad allora sconosciuti, ma metteva insieme conoscenze già consolidate sull’effetto disperdente dei prismi, esperienze decennali sull’analisi delle fiamme prodotte da varie sostanze chimiche, aggiungendo però l’importante innovazione del bruciatore, che prese il nome di ‘becco Bunsen’, per ottenere fiamme più ‘pulite’ e più semplici da analizzare. Nel primo strumento Bunsen e Kirchhoff assemblarono sullo stesso piano un telescopio collimatore, un telescopio oculare e un prisma, contenuto in una scatola con le pareti annerite (Figura 1).2
 Figura 1. Fotografia di uno spettroscopio storico dell’Università di Pisa, a due braccia come il primo spettroscopio realizzato da Kirchhoff e Bunsen nel 1859.
Figura 1. Fotografia di uno spettroscopio storico dell’Università di Pisa, a due braccia come il primo spettroscopio realizzato da Kirchhoff e Bunsen nel 1859.
Bunsen e Kirchhoff notarono che quando un sale veniva vaporizzato nella fiamma prodotta dal becco Bunsen la luce emessa, analizzata attraverso lo spettroscopio, mostrava una doppia linea gialla esattamente nella stessa posizione della linea scura D dello spettro solare. A questo punto tentarono di far passare contemporaneamente la luce solare e la luce della fiamma prodotta dal sale di sodio nello spettroscopio per osservare insieme la linea brillante e quella scura dei due spettri e furono molto meravigliati nell’osservare che la linea D scura dello spettro solare non diventava la linea brillante emessa dalla fiamma nella quale era posto il sale, ma diventava ancora più scura, in analogia con quanto già osservato da Foucault. Kirchhoff inizialmente fu molto perplesso e pensò a quanto osservato per un giorno e per una notte. Poi decise di fare un altro esperimento: al posto della luce solare, prima della fiamma con il sale, collocò una fiamma luminosa che mostrava tutto lo spettro visibile, ma senza le linee scure dello spettro solare. Davanti a essa pose la fiamma prodotta dal sale di sodio e analizzò la luce con lo spettroscopio. Osservò che in questo caso nello spettro continuo compariva proprio la linea scura ‘D’: aveva osservato uno spettro di assorbimento del sodio ‘pulito’. La spiegazione che Kirchhoff diede è che la luce bianca (continua) emessa dalla fiamma perdesse le “vibrazioni” della linea gialla proprio per effetto del sale, e quindi questo spiegava la presenza di una linea scura al posto della linea brillante.1
Kirchhoff arrivò poi alla formulazione delle sue tre leggi empiriche della spettroscopia, che possono essere così formulate anche alla luce delle conoscenze di oggi: 1) un solido, un liquido o un gas molto denso se riscaldati ad alte temperature emettono luce visibile di tutte le lunghezze d’onda, ovvero producono uno spettro continuo, 2) un gas rarefatto, caldo emette luce di lunghezze d’onda ben precise e il suo spettro è fatto da righe luminose (colorate) su un fondo nero, ovvero produce uno spettro di emissione, 3) lo stesso gas rarefatto, molto più freddo, posto davanti ad una sorgente luminosa, più calda, che produce uno spettro continuo, assorbe quelle stesse lunghezze d’onda, e produce uno spettro di righe scure su sfondo colorato, ovvero uno spettro di assorbimento. Queste leggi empiriche furono anche alla base della comprensione degli spettri di luce emessa dalle stelle e della relazione tra colore delle stelle e composizione chimica.5 Va ricordato inoltre, che i due scienziati utilizzando il nuovo strumento, scoprirono nuovi elementi chimici: già nel 1860, annunciarono la scoperta del Cesio, chiamato così per le intense linee blu del suo spettro, e pochi mesi dopo, nel 1861, il Rubidio, che prese nome dal rosso profondo di alcune sue linee più intense. Quasi contemporaneamente, William Crookes (1832-1919), esaminando con lo spettroscopio i residui di lavorazione di un impianto, notò delle brillanti linee verdi che non erano mai state viste prima che appartenevano a un nuovo elemento e in una comunicazione scientifica del 1861 chiamò questo elemento Tallio. In modo analogo nel 1863, Richter e Reich scoprirono un elemento che dava origine a due brillanti linee blu: l’elemento era l’Indio. Altri elementi furono in seguito scoperti con il contributo fondamentale dello spettroscopio: Gallio, Elio, Itterbio, Olmio, Tulio, Samario, Neodimio, Praseodimio e Lutezio.
Conclusioni
Gustav Kirchhoff e Robert Bunsen hanno realizzato la sintesi di una lunga ricerca realizzata dai loro predecessori: ad essi va il merito di aver visto l’analisi spettrale in un quadro più ampio e di averla spinta fino a portarla a significative applicazioni. Questa breve presentazione della storia dello spettroscopio di Kirchhoff-Bunsen, anche se non si è soffermata sulle implicazioni che lo strumento ha avuto per la nascita dell’Astrofisica, si conclude citando una frase di Friederich Wilhelm Ostwald, premio Nobel per la Chimica nel 1909, tratta dal suo libro biografico “Manner der Wissenschaft (Uomini di scienza) - R.W. Bunsen”, del 1905:6
“Thus there was for him nothing small or great in Nature. Every phenomenon embraced for him an endless diversity of factors, and in the yellow flame of an ordinary alcohol lamp whose wick was sprinkled with salt, he saw the possibility of accomplishing the chemical analysis of the most distant stars”.
 Figura 2. Esperimento con lo spettroscopio di Kirchhoff-Bunsen (a tre braccia)7 didattico e la lampada spettroscopica al sodio nei laboratori dell’I.S.S.” Galilei-Sani” di Latina.
Figura 2. Esperimento con lo spettroscopio di Kirchhoff-Bunsen (a tre braccia)7 didattico e la lampada spettroscopica al sodio nei laboratori dell’I.S.S.” Galilei-Sani” di Latina.
Riferimenti
(1) Weeks, Z.E. The discovery of elements. XIII. Some spectroscopic discoveries. Journal of Chemical Education 1932, 9 (18), 1413.
(2) Pearson, T.H.; Ihde, A.J. Chemistry and spectrum before Bunsen and Kirchhoff. Journal of Chemical Education 1951, 9 (18), 267.
(3) Thomas, N.C. The Early History of Spectroscopy. Journal of Chemical Education 1991, 68 (8), 631.
(4) Lockemann, G. The centenary of the Bunsen burner. Journal of Chemical Education 1966, 33 (1), 20.
(5) Link al video didattico sulla nascita della spettroscopia: https://youtu.be/sKA9_kptThc
(6) Ostwald, Wilhelm: R. W. Bunsen. Leipzig 1905 (Männer der Wissenschaft. Eine Sammlung von Lebensbeschreibungen zur Geschichte der wissenschaftlichen Forschung und Praxis 2), 1-40.
(7) Link al video didattico sullo spettroscopio di Kirchhoff-Bunsen a tre braccia: https://youtu.be/cuMD3maL-us



