Articolo di Elena Catania
Alcuni composti di coordinazione a base di lantanidi possono essere impiegati in ambito biomedico come potenziali farmaci antitumorali. Inoltre, grazie alla loro particolare proprietà di luminescenza possono essere utilizzati come sonde luminescenti ed essere così visualizzati all’interno delle cellule tumorali. In questo articolo sarà presentata una breve introduzione riguardante le terre rare, la loro scoperta e le loro principali applicazioni, soffermandosi sul loro utilizzo in campo biomedico. Inoltre, un breve approfondimento sarà dedicato alla fluorescenza e alla sua scoperta. Per visualizzare il concetto di fluorescenza sarà utilizzato un esempio di una sostanza di uso quotidiano in grado di dare questo fenomeno. Infine sarà presentata la sintesi di un complesso luminescente a base di europio, effettuata in laboratorio durante il tirocinio di tesi magistrale dell’autrice.
Introduzione
Nel 1787, il tenente dell’esercito e chimico part time svedese, Carl Axel Arrhenius, entrò in una vecchia cava vicino al villaggio di Ytterby, in Svezia, oggi riconosciuta come ‘patrimonio storico’.1,2 Si emozionò imbattendosi in una strana roccia nera e pesante. Il minerale itterbite, così chiamato da Arrhenius, venne spedito ad alcuni chimici che lo analizzarono. In seguito, il minerale prese il nome di uno di questi chimici, Gadolin. 2,3 Quest’ultimo era un abile chimico analitico e la sua ricerca gli permise di scoprire, nel 1794, all’interno del minerale, la prima terra rara, l'Ittrio. L’Ittrio scoperto da Gadolin è risultato essere, nel corso di diversi decenni, una miscela di una serie di "terre rare pesanti" tra cui l’Erbio (scoperto nel 1842), il Terbio (1842) e l’Itterbio (1878). Anche la scoperta degli elementi Gadolinio, Scandio, Tulio e Olmio è collegata alla miniera di Ytterby.3,4
I lantanidi sono dei metalli lucenti, inizialmente scoperti in minerali poco diffusi e per questo chiamati terre rare. In realtà si trovano più diffusamente di quanto si ritenesse un tempo. I lantanidi sono 14 elementi che si collocano all’interno della tavola periodica, nel blocco ‘f’, infatti, i loro elettroni più esterni si trovano negli orbitali atomici ‘f’. Questi elementi e i loro composti hanno una particolare caratteristica: sono in grado di emettere luce. Grazie alle proprietà di luminescenza vengono utilizzati per la fabbricazione di alcuni oggetti, quali laser per la chirurgia oculare, sistemi di illuminazione LED, schermi, sistemi di sicurezza e anticontraffazione.5,6
Un particolare fenomeno di emissione di luce è la fluorescenza. Un materiale fluorescente si illumina quando viene colpito da un raggio di luce, ad esempio una particolare radiazione ultravioletta. Questo materiale ha la capacità di assorbire la luce ultravioletta e riemettere luce nella regione dello spettro visibile o nella regione dell’ultravioletto, ma comunque sempre a lunghezze d’onda maggiori rispetto alla radiazione assorbita.
Nel 1845, John Herschel, astronomo, matematico e chimico britannico descrisse la fluorescenza in letteratura scientifica. Herschel osservò che una soluzione incolore di solfato di chinino, se esposta alla luce del sole, sviluppava un colore blu.7 Molte sostanze naturali e artificiali sono fluorescenti, ad esempio, illuminando con una torcia a luce ultravioletta una bottiglia di acqua tonica, in una stanza completamente oscurata, è possibile osservare un’intensa fluorescenza nelle lunghezze d’onda del blu (Figura 1). Ciò è dovuto proprio alla presenza del chinino nella bevanda! Il chinino, grazie alla sua struttura molecolare (Figura 2), è in grado di assorbire la luce ultravioletta della torcia e di riemetterla come luce blu.

Figura 1. Fluorescenza blu dell’acqua tonica.
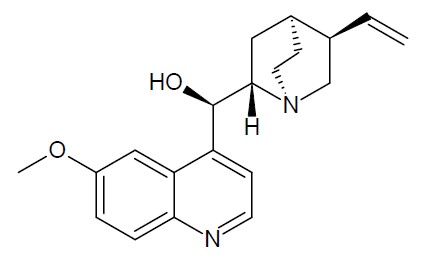
Figura 2. Struttura molecolare del chinino.
Come si può notare dalla Figura 2, la molecola del chinino presenta due anelli aromatici e una struttura relativamente rigida, questo spiega perché osserviamo la fluorescenza.8 Per una spiegazione più esaustiva del fenomeno della fluorescenza e dei principi quanto-meccanici si rimanda ai riferimenti 9, 10, 11.
Alcuni ioni dei lantanidi, indicati con Ln3+, sono fosforescenti (ad esempio: Eu3+, Tb3+), altri sono fluorescenti (ad esempio: Ho3+, Yb3+), mentre molti di loro sono sia fluorescenti che fosforescenti (ad esempio: Pr3+, Nd3+).
La fotoluminescenza, come detto precedentemente, è un processo che si verifica dopo una foto-eccitazione, ovvero dopo che un materiale viene irradiato con la luce. L’intensità di emissione dipende sia dalla quantità di luce assorbita sia dalle caratteristiche del materiale. Il meccanismo di assorbimento e di emissione della luce è legato alla struttura elettronica dei materiali. Ad esempio, nel caso degli ioni lantanidici esistono molti livelli energetici e quindi sono possibili vari assorbimenti di luce con diverse lunghezze d’onda. La maggior parte degli ioni lantanidici trivalenti sono luminescenti e, ad eccezione del Ce3+, le transizioni corrispondenti si verificano principalmente come transizioni degli elettroni tra i livelli ‘f’–‘f’. Dal momento che tali transizioni sono proibite dalle regole di selezione di Laporte, gli ioni lantanidici danno generalmente emissioni deboli. 12
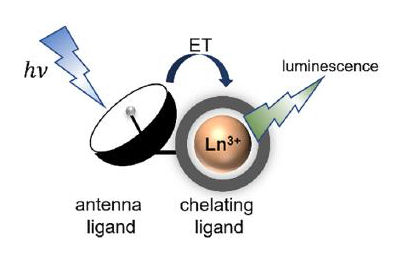
Tuttavia, l’intensità dell'emissione degli ioni lantanidici può essere notevolmente aumentata circondando gli ioni con molecole che funzionano come delle vere e proprie antenne, in grado di raccogliere, ovvero assorbire, la luce e di trasferirla al metallo, il quale può così emettere luce più efficientemente. Si parla quindi di effetto antenna.13 Nel 1942 Weissman per primo dimostrò che la luminescenza degli ioni lantanidici può essere potenziata da ligandi organici, che svolgono il ruolo di antenna. 14
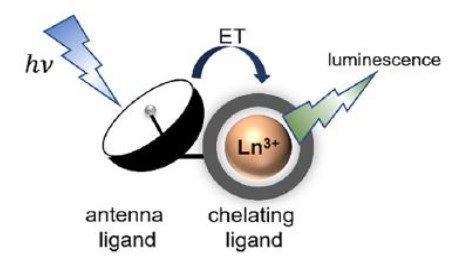
Figura 3. Meccanismo di luminescenza per complessi lantanidici. 13
Come illustrato nella Figura 3, lo ione lantanidico viene legato da una molecola detta ‘chelante’ tramite più di un legame coordinativo. Il complesso così risultante gode di una struttura molto stabile in quanto l'atomo centrale è circondato dal chelante, come se fosse stretto tra le chele di un granchio, come vedremo successivamente.12 Il legante antenna, in questo caso, si trova collegato al legante chelante.
Una delle applicazioni più interessanti della proprietà di luminescenza dei lantanidi è in campo medico e in particolare per l’individuazione delle cellule tumorali: i complessi di coordinazione a base di ioni lantanidici possono essere infatti utilizzati come sonde luminescenti.15 Una volta che i complessi si legano alle cellule tumorali, vengono eccitati con luce ultravioletta, ed emettono luce nel visibile, rendendo possibile visualizzare e monitorare il tumore in tempo reale. Le sonde luminescenti più comuni sono generalmente costituite da tre componenti principali: uno ione lantanidico, un ligando chelante organico e un'antenna sensibilizzante. Quando questi tre elementi sono combinati in modo ottimale, si ottengono sonde luminescenti altamente efficaci. 16
Un caso particolare: i complessi dell’Europio
L'Europio è un metallo che fa parte dei lantanidi e può avere due stati di ossidazione principali (+2 e +3), da cui dipendono le proprietà magnetiche e ottiche. Queste caratteristiche possono essere modificate tramite la chimica di coordinazione e sono utili in diverse applicazioni, come la risonanza magnetica e altre tecniche diagnostiche e la catalisi.17, 18 La chimica dell’Europio, come in generale dei lantanidi, è elettrostatica. Quindi i complessi di Europio sono tenuti insieme da deboli forze elettrostatiche e il numero di coordinazione (CN) degli ioni lantanidici è influenzato dai fattori sterici. Il più comune numero di coordinazione per gli ioni Ln3+ è 8 o 9, come mostrato in Figura 4.19, 20
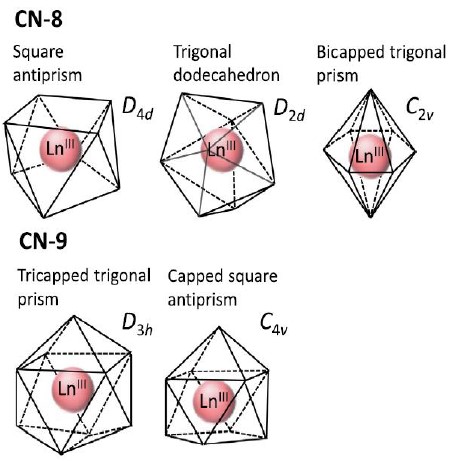
Figura 4. Strutture di coordinazione più comuni nei complessi dei lantanidi. 20
A titolo di esempio descriverò uno dei complessi che sono oggetto della mia tesi di laurea magistrale.
La salicilaldeide e la fenantrolina sono due possibili leganti chelanti (Figura 5 e Figura 6). La fenantrolina, inoltre, ha la funzione di antenna. Sono proprio queste due molecole organiche che ho utilizzato nel mio tirocinio di tesi magistrale per “costruire” un complesso a base del lantanide Europio, seguendo la procedura, in parte modificata, riportata in letteratura.21 Oltre ai leganti, per costruire il complesso, occorre un precursore a base di Europio, nel nostro caso nitrato di Europio pentaidrato (Eu(NO3)3*5H2O) (Figura 5) in cui il metallo si trova nella forma ionica Eu3+.

Figura 5. I reagenti per la sintesi del complesso. A sinistra: salicilaldeide (Hsal), un liquido giallo; al centro: fenantrolina (phen), un solido cristallino bianco; a destra: nitrato di europio pentaidrato (Eu(NO3)3*5H2O), un solido polveroso bianco.
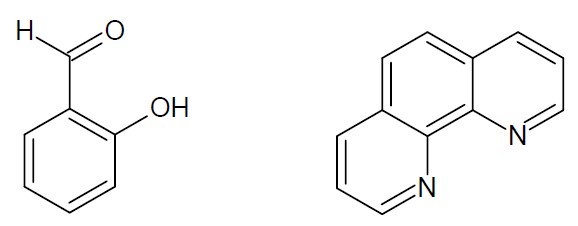
Figura 6. Struttura molecolare dei reagenti. A sinistra: salicilaldeide (Hsal); a destra: fenantrolina (phen).
La reazione di sintesi è riportata nello Schema 1: i reagenti (liquidi o solidi polverosi), vengono inseriti in un recipiente di vetro e poi sciolti nel solvente, il metanolo (MeOH). Il tutto è tenuto in agitazione grazie ad un sistema di agitazione magnetica. Dopo circa un’ora, la reazione tra i reagenti porta alla formazione del prodotto. Si osserva infatti un solido all’interno della soluzione che precipita sul fondo del recipiente. Effettuando, poi, una filtrazione (Figura 7), viene recuperato un solido giallo che viene separato dal liquido, seccato ed inserito in provetta di vetro (Figura 8, a sinistra).
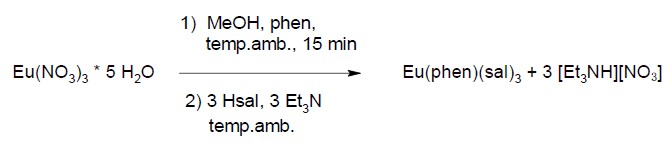
Schema 1. Reazione di sintesi del complesso Eu(phen)(sal)3. Il precursore nitrato di europio pentaidrato (Eu(NO3)3*5H2O) reagisce con la fenantrolina (phen) e con la salicilaldeide (Hsal). Quest’ultima viene deprotonata dalla trietilammina (Et3N, che si presenta come un liquido incolore) e si forma il complesso Eu(phen)(sal)3. Il metanolo, liquido incolore, è il solvente nel quale avviene la reazione.

Figura 7. Filtrazione: il prodotto di reazione viene recuperato sul filtro.
Il complesso di Europio sintetizzato in questo lavoro di tesi presenta una forte luminescenza, come si può notare in Figura 8. Alla luce visibile il complesso si presenta infatti come una polvere gialla, ma irraggiandolo con una luce ultravioletta, la polvere emette una luce nel rosso molto intensa.

Figura 8. Il prodotto di reazione: il complesso Eu(phen)(sal)3. A sinistra: un solido polveroso giallo ottenuto dalla reazione. A destra: la luminescenza rossa osservata in una stanza buia, illuminando il solido giallo con una torcia a luce UV.
La struttura del complesso finale, riportata nella Figura 9, evidenzia la tipica struttura dei complessi di lantanidi con tre molecole di salicilaldeide deprotonata (sal) e una di fenantrolina (phen) che complessano lo ione centrale (effetto chelante). È proprio la molecola di fenantrolina ad agire da antenna e ad aumentare la luminescenza da parte del complesso.
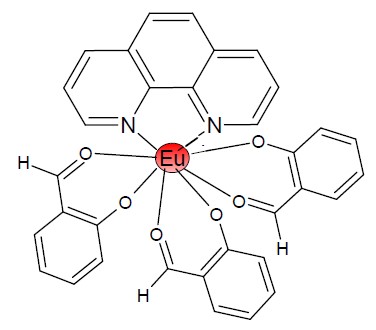
Figura 9. Struttura molecolare del prodotto di reazione: il complesso Eu(phen)(sal)3.
Questo complesso sarà in seguito studiato per capire le sue potenziali utilità in ambito medico. Oltre agli studi sull’attività citotossica, come detto precedentemente, verranno effettuati studi di assorbimento elettronico e di fluorescenza di Eu(phen)(sal)3 al fine di verificare l’utilità di questo come sonda luminescente, in modo da poterlo utilizzare nelle tecniche diagnostiche di microscopia.
Ringraziamenti
Ai professori per il supporto durante il tirocinio di tesi: Simona Samaritani, Valentina Domenici, Luca Labella. Al dottorando Marco Bazi, all’assegnista Alessandro Rogai e ai compagni di laboratorio di tesi: Giulia Ludovisi, Matteo Tomassoni, Chiara Giuntini, Jennifer Giani, Flavia Seghieri, Francesco Filippi, Anna Dell’Amico, Maria Durante e Guglielmo Giannini per il loro supporto durante la tesi e per l’aiuto con la parte fotografica.
Riferimenti
(1) Yttrium and Johan Gadolin, James L. Marshall, Beta Eta 1971, Virginia R. Marshall, Beta Eta 2003, THE HEXAGON/SPRING 2008, 8-11
(2) https://www.euchems.eu/wp-content/uploads/2019/05/Press-release-Ytterby-mine-EuChemS-29-04-2019.pdf
(3) https://old.iupac.org/publications/ci/2010/3206/si.html
(4) https://it.wikipedia.org/wiki/Carl_Axel_Arrhenius
(5) Jean-Claude G. Bünzli; Lanthanide Luminescence: From a Mystery to Rationalization, Understanding, and Applications. Handbook on the Physics and Chemistry of Rare Earths. http://dx.doi.org/10.1016/bs.hpcre.2016.08.003
(6) Rare earths: jewels for functional materials of the future, New J.Chem., 2011, 35, 1165–1176.
(7) Principles of Fluorescence Spectroscopy Joseph R. Lakowicz, Springer, 2006, ISBN 0-387-31278-1. https://it.wikipedia.org/wiki/Fluorescenza
(8) N. I. Nijegorodov, W. S. DowneyJ., Phys. Chem. 1994, 98, 22, 5639–5643
(9) E.N. Harvey, A History of Luminescence. From the Earliest Times Until 1900, American Philosophical Society, Philadelphia, 1957. https://archive.org/details/historyoflumines00harv/page/n11/mode/2up
(10) Peter Atkins, Julio De Paula, Chimica Fisica, 4ª ed., Bologna, Zanichelli, 2004, ISBN 88-08-09649-1.
(11) J. R. Lakowicz (Ed.), Principles of Fluorescence Spectroscopy, 3rd ed., Springer, Singapore, 2006. chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://nathan.instras.com/MyDocsDB/doc-800.pdf
(12) G. Bao, J. Lumin., 2020, 228, 117622.
(13) R. Sivakumar, N. Y. Lee, Coord. Chem. Rev., 2024, 501, 215563.
(14) S.I. Weissman, J. Chem. Phys. 10 (1942) 214–217, https://doi.org/10.1063/1.1723709
(15) A. Dalal, K. Nehra, A. Hooda, D. Singh, P. Kumar, S. Kumar, R. S. Malik, B. Rathi, Inorganica Chim. Acta, 550 (2023) 121406, https://doi.org/10.1016/j.ica.2023.121406
(16) M. Hasegawa, H. Ohmagari, H. Tanaka, K. Machida, Journal of Photochemistry & Photobiology, C: Photochemistry Reviews 50 (2022) 100484.
(17) Waygen Thora, Albano N. Carneiro Netob, Renaldo T. Moura Jr.c,d, Ka-Leung Wonga, Peter A. Tanner, Coordination Chemistry Reviews, 517 (2024) 215927.
(18) E. C. Lewandowski, C. B. Arban, M. P. Deal, Andrea L. Batchev, M. J. Allen, Chem. Commun., 2024, 60, 10655-10671.
(19) Moeller, Therald (2013). The Chemistry of the Lanthanides. Pergamon. pp. 39–44. ISBN 978-1483187631. LINK: https://books.google.it/books?id=dkr-BAAAQBAJ&pg=PA41&redir_esc=y#v=onepage&q&f=false
(20) P. P. F. da Rosa, Y. Kitagawa, Y. Hasegawa, Coord. Chem. Rev., 2020, 406, 213153.
(21) D. Dragancea, T. Mocanu, D. Avram, M. Raduca, C. Tiseanu, M. Andruh, Polyhedron 252 (2024) 116886, https://doi.org/10.1016/j.poly.2024.116886



