Articolo divulgativo in Chimica fisica di
Valentina Domenici I cristalli liquidi e i cosiddetti materiali ‘soffici’ fanno parte integrante della nostra vita, tuttavia in nessun livello scolastico che precede gli studi universitari si parla dell’esistenza di stati della materia diversi da quello solido, liquido e gassoso, e, dove ne viene fatto un accenno, l’argomento rimane alquanto vago e marginale, se non costellato di piccoli (o grandi) errori che di certo non facilitano gli studenti alla comprensione. In questo breve articolo, introdurrò un approccio didattico in fase di sperimentazione per introdurre i cristalli liquidi a livello di scuola secondaria di II grado. Il percorso, che può essere articolato con diversi gradi di approfondimento in relazione al tipo di scuola, dovrebbe servire a scardinare alcuni preconcetti in merito agli stati di aggregazione della materia e aiutare a comprendere alcuni fenomeni e proprietà dei materiali che gli studenti incontrano nella vita e nel loro percorso di studi.
I cristalli liquidi e i cosiddetti materiali ‘soffici’ fanno parte integrante della nostra vita, tuttavia in nessun livello scolastico che precede gli studi universitari si parla dell’esistenza di stati della materia diversi da quello solido, liquido e gassoso, e, dove ne viene fatto un accenno, l’argomento rimane alquanto vago e marginale, se non costellato di piccoli (o grandi) errori che di certo non facilitano gli studenti alla comprensione. In questo breve articolo, introdurrò un approccio didattico in fase di sperimentazione per introdurre i cristalli liquidi a livello di scuola secondaria di II grado. Il percorso, che può essere articolato con diversi gradi di approfondimento in relazione al tipo di scuola, dovrebbe servire a scardinare alcuni preconcetti in merito agli stati di aggregazione della materia e aiutare a comprendere alcuni fenomeni e proprietà dei materiali che gli studenti incontrano nella vita e nel loro percorso di studi.
Introduzione
Chiunque si ricordi del suo primo approccio scolastico agli stati della materia, probabilmente avrà memoria di alcuni classici esperimenti sui passaggi di stato, ad esempio, da acqua liquida a ghiaccio, e viceversa, oppure quelli che portano a definire alcune proprietà macroscopiche dei solidi, dei liquidi e dei gas, come: ‘i liquidi occupano la forma del recipiente, ma hanno un volume proprio’, ‘i solidi hanno un volume e una forma propria’, etc… La maggior parte degli esperimenti e delle attività didattiche sugli stati della materia ha come protagonista l’acqua, nonostante, sia ben noto che l’acqua ha proprietà molto peculiari e diverse dalle altre sostanze, ad esempio, aumenta di volume alla transizione da liquido a solido. D’altra parte, la centralità della sostanza acqua nella nostra vita, rispetto a tutte le altre sostanze, è uno dei motivi principali di questa scelta didattica. Una volta definite le proprietà della sostanza acqua nei tre stati della materia, ovvero lo stato solido, lo stato liquido e lo stato gassoso (senza considerare che lo stato solido di cui parliamo solitamente è solo uno degli stati cristallini dell’acqua), solitamente viene introdotto, a livello di scuola secondaria di I grado, il modello particellare, che è un primo modello rudimentale per introdurre il carattere discontinuo della materia e che risulta molto efficacie proprio per descrivere a livello sub-microscopico i tre stati della materia. Secondo questo modello, l’acqua, come qualsiasi altra sostanza, è costituita da ‘particelle’ tutte uguali, tipicamente rappresentate come sferette.1 Generalmente questo modello viene utilizzato per rappresentare anche altre sostanze, dall’alcol al sale, dall’ossigeno allo zucchero, con l’accorgimento che ogni sostanza dovrà essere rappresentata da ‘particelle’ con caratteristiche diverse (colore, dimensioni, …) come riportato in Figura 1.2 Il passo successivo nella sequenza didattica consiste nello studio dei miscugli e delle miscele di sostanze, fino ad arrivare alle soluzioni acquose, alla concentrazione e così via…
Il percorso didattico, tuttavia, non è così lineare come potrebbe sembrare e l’estensione di un modello così semplice alle sostanze, e più in generale ai materiali, che utilizziamo nella vita di tutti i giorni riserva una serie di aspetti problematici che è meglio non trascurare per i loro risvolti nell’apprendimento dei concetti fondamentali della chimica. Ad esempio, come possiamo rispondere a domande fatte dai ragazzi del tipo: il formaggio è un liquido o un solido? E il latte, e lo yogurt? E come spiegare il fenomeno della detergenza e l’effetto dei saponi? Per non parlare di alcuni argomenti di biologia, che vengono insegnati già alla scuola primaria, che implicano una conoscenza delle membrane cellulari e delle loro strutture parzialmente ordinate.
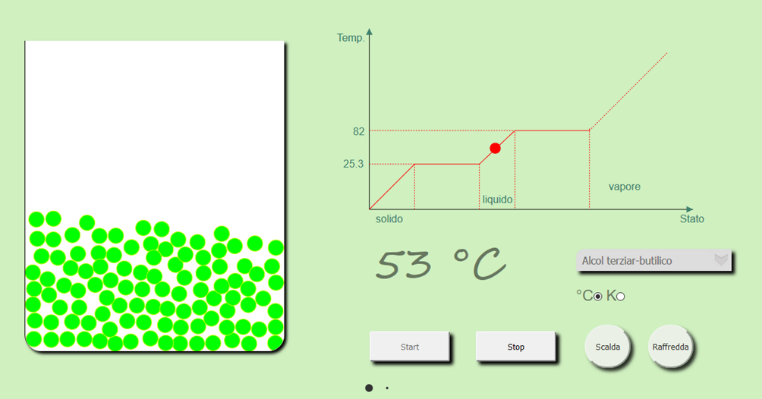 Figura 1. Fermo-immagine di un programma utilizzato per descrivere i passaggi di stato utilizzando il modello particellare,
Figura 1. Fermo-immagine di un programma utilizzato per descrivere i passaggi di stato utilizzando il modello particellare,
realizzato nell’ambito di alcune tesi di laurea magistrale di informatica umanistica.2-4
Partendo da queste considerazioni e dall’esperienza maturata negli anni facendo ricerca nel campo dei cristalli liquidi, nell’ambito della Scuola Nazionale di Didattica della Chimica ‘Giuseppe Del Re’ (edizione 2021-2022) ho proposto, in collaborazione con il Sandro Jurinovich, docente dell’istituto tecnico ‘Cattaneo’ di San Miniato, un percorso didattico sui cristalli liquidi,5 un tipo particolare di materiali che rientra nella ‘soft matter’,6-7 che permettesse di introdurre alcuni concetti, utili per arrivare a rispondere in maniera corretta alle domande poste dai ragazzi. La prima parte del percorso riguarda i cristalli liquidi termotropici, sostanze formate da un solo tipo di molecole, che presentano oltre agli stati della materia di cui sopra, anche altri stati di aggregazione, detti anche ‘fasi liquido cristalline’, caratterizzate da diversi gradi di ordine. Su questa prima parte del percorso commenterò in questo breve articolo alcune attività di introduzione ai cristalli liquidi e la loro rilevanza dal punto di vista didattico. La seconda parte del percorso, che non sarà commentata in questo articolo, riguarda i cristalli liquidi liotropici, sistemi molto più complessi dei termotropici, perché costituiti da due o più sostanze, che possono formare strutture parzialmente organizzate non solo in funzione della temperatura, ma soprattutto della concentrazione delle diverse sostanze che li compongono.
Cristalli liquidi termotropici e passaggi di stato
I cristalli liquidi termotropici sono stati i primi ad essere scoperti nel 1888 dal botanico Friedrich Reinitzer, mentre cercava di purificare un derivato del colesterolo: il colesteril-benzoato. La storia della scoperta è assai significativa anche dal punto di vista didattico, in quanto la scoperta dei cristalli liquidi è associata allo studio delle temperature di transizione di fase e, nel caso particolare, al tentativo di Reinitzer di individuare la temperatura di fusione del derivato del colesterolo. Scaldando e raffreddando più volte il suo composto, Reinitzer si accorse della presenza di quello che in apparenza sembrava essere un doppio fenomeno di fusione: dallo stato solido, una volta raggiunta la temperatura di 145.5°C, i cristalli passavano ad uno stato di liquido lattiginoso, molto viscoso e opaco, e, scaldando ancora, alla temperatura di 178.5°C, si otteneva un liquido trasparente.8 Fra i due ‘punti di fusione’ Reinitzer notava la presenza di colori iridescenti, con prevalenza di blu e viola, e di chiari fenomeni di birifrangenza. Esclusa la presenza di impurezze, non riuscendo a trovare una spiegazione plausibile alle sue osservazioni e alla presenza di due temperature di transizione, inviò un po’ del suo campione al fisico Otto Lehmann, ritenuto uno dei massimi esperti di transizioni di fase e di microscopia ottica. Fu lui a capire che il liquido opaco e iridescente osservato da Reinitzer era un vero e proprio stato della materia, mai osservato prima, che chiamò ‘cristallo liquido’,9 perché al microscopio Lehmann osservava figure compatibili alla presenza di strutture cristalline che scorrevano. Oggi sappiamo che la fase osservata da Lehmann era una fase nematica chirale, chiamata ‘colesterica’ proprio per ricordare il primo cristallo liquido di questo tipo. Partendo proprio dall’episodio storico, la sequenza didattica parte dall’osservazione di un cristallo liquido ‘nematico’ a temperatura ambiente, come il 5CB (4-pentil-4’-cianobifenile) o una delle miscele commerciali che si possono acquistare on-line (Figura 2). La maggioranza degli studenti avrà già sentito parlare dei ‘cristalli liquidi’ a proposito dei display a cristalli liquidi, che rappresentano una delle più popolari applicazioni di questi materiali. Tuttavia, nessuno probabilmente avrà mai visto prima un cristallo liquido. L’osservazione di un nematico a temperatura ambiente può rappresentare un interessante momento per mettere in discussione le conoscenze pregresse degli studenti sugli stati della materia. Il nematico infatti si presenza come un fluido, viscoso, totalmente opaco, dalla consistenza lattiginosa. Possiamo definire questo stato della materia ‘liquido’? Riprendendo la narrazione storica e gli esperimenti di Reinitzer, dopo aver stimolato gli studenti, proviamo a scaldare il cristallo liquido per vedere se le sue proprietà macroscopiche cambiano con la temperatura.
 Figura 2. Fermo immagine del video didattico introduttivo sui cristalli liquidi realizzato per la formazione
Figura 2. Fermo immagine del video didattico introduttivo sui cristalli liquidi realizzato per la formazione
degli insegnanti della Scuola Nazionale di Didattica della Chimica ‘Giuseppe Del Re’.5
Gli studenti noteranno che scaldando il nematico, ad una temperatura ben precisa, il cristallo liquido passerà dalla consistenza di un liquido opaco e lattiginoso a quella di un liquido trasparente, molto meno viscoso (Schema 1).
 Schema 1. Comportamento di un cristallo liquido nematico a temperatura ambiente sottoposto a riscaldamento fino al raggiungimento dello stato liquido (isotropo). La fotografia centrale mostra macroscopicamente cosa accade alla temperatura di transizione da nematico a liquido (isotropo).
Schema 1. Comportamento di un cristallo liquido nematico a temperatura ambiente sottoposto a riscaldamento fino al raggiungimento dello stato liquido (isotropo). La fotografia centrale mostra macroscopicamente cosa accade alla temperatura di transizione da nematico a liquido (isotropo).
Questa esperienza può essere ripetuta varie volte, aumentando e abbassando la temperatura, e in modo più accurato, controllando la temperatura, ad esempio utilizzando un bagnomaria su una piastra scaldante e un termometro per misurare la temperatura. Gli studenti noteranno che la temperatura a cui si osserva il cambiamento di stato, ovvero la temperatura di transizione di fase da liquido a nematico e viceversa, è una temperatura specifica, proprio come accade con le temperature di fusione, solidificazione, condensazione ed ebollizione, che sono a loro più familiari. Per comprendere meglio il perché questo materiale abbia questo comportamento e per capire la natura di questo ‘nuovo’ stato della materia, occorre riprendere il modello particellare e quindi passare dal livello macroscopico-fenomenologico al livello submicroscopico-molecolare, secondo il ben noto modello triangolare di Johnstone dell’insegnamento della chimica.10 Questa volta però le molecole non possono più essere rappresentate da delle sferette, perché è proprio la forma delle molecole la chiave per capire perché alcune sostanze presentano le fasi liquido cristalline. Si introduce quindi il concetto di anisotropia associato alla forma, tipicamente ellissoidale, delle molecole che costituiscono i cristalli liquidi termotropici. Mentre nel caso di molecole di forma sferica, l’organizzazione spaziale e il loro impaccamento, non dipende dall’orientazione delle sfere, nel caso delle molecole a forma di ‘bastoncino’ (rod-like in inglese), l’orientazione reciproca delle molecole diventa importante. L’uso di modelli, anche su scala ingrandita, può essere utile per far capire che possono esistere vari modi e quindi varie strutture in cui organizzare queste molecole nelle tre direzioni dello spazio.11 La struttura della fase nematica, ad esempio, è caratterizzata da un ordine orientazionale,12 che localmente si spiega immaginando le molecole allungate disposte con gli assi lungo-molecolari mediamente allineati, a formare domini o aggregati dove questo grado di ordine locale può essere rappresentato da una freccia, il direttore della fase nematica (Schema 2).
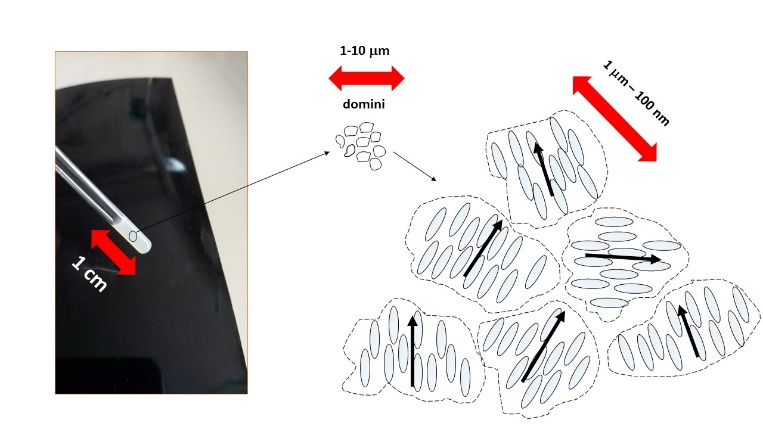 Schema 2. A sinistra: fotografia di un cristallo liquido ‘nematico’ inserito in un tubo da NMR. A destra: schema che rappresenta la struttura a livello microscopico dei domini, ovvero aggregati di molecole liquido-cristalline, rappresentate da bastoncini, allineate lungo una direzione (freccia nera), che cambia da dominio a dominio, risultando in una distribuzione isotropa di orientazioni.
Schema 2. A sinistra: fotografia di un cristallo liquido ‘nematico’ inserito in un tubo da NMR. A destra: schema che rappresenta la struttura a livello microscopico dei domini, ovvero aggregati di molecole liquido-cristalline, rappresentate da bastoncini, allineate lungo una direzione (freccia nera), che cambia da dominio a dominio, risultando in una distribuzione isotropa di orientazioni.
E’ utile poi far trovare agli studenti la spiegazione ‘molecolare’ delle proprietà macroscopiche del cristallo liquido nematico. Perché questa fase appare opaca e lattiginosa? Gli studenti dovrebbero ragionare sulle caratteristiche dei domini, come riportato nello Schema 2, per giungere alla spiegazione che correla la dimensione media dei domini di molecole nella fase nematica all’intervallo di lunghezze d’onda della luce visibile, comprese tra i 380 e i 740 nm. Per aiutarli, possiamo anche richiamare o mostrare l’effetto Tyndall,13 che si osserva anche con le dispersioni colloidali, come il latte. La spiegazione delle proprietà ottiche dei cristalli liquidi, come l’opacità delle fasi nematiche, la birifrangenza e la comparsa di colori blu e violetto delle fasi colesteriche, rappresentano ulteriori esempi di esperimenti proposti nella sequenza didattica di introduzione ai cristalli liquidi, propedeutici alla comprensione del funzionamento dei display a cristalli liquidi.6,7 La seconda parte del percorso didattico, in fase di sperimentazione in alcune classi di scuole secondarie di II grado, è centrata sui cristalli liquidi liotropici, sistemi eterogenei più complessi, la cui comprensione è importante per una serie di argomenti che sono trattati a livello scolastico, come le proprietà delle membrane cellulari in biologia e la polarità dei composti chimici in chimica organica. Il percorso didattico è organizzato con una serie di esperimenti e attività interattive per introdurre alcune proprietà chimico-fisiche dei tensioattivi, come la tensione superficiale, e per spiegare alcuni fenomeni, come la detergenza e la formazione delle schiume.14 Come per i cristalli liquidi termotropici, l’utilizzo dei modelli molecolari per rappresentare i tensioattivi e altre sostanze, come l’acqua e l’acido oleico, è utile per visualizzare meglio le strutture parzialmente organizzate che si possono formare al variare della concentrazione relativa delle sostanze che compongono i liotropici, come le micelle e i doppi strati o fasi lamellari.
Riferimenti
(1) Domenici, V. Insegnare e apprendere chimica, Mondadori Università, Firenze: 2018. ISBN: 978-8861846005.
(2) Belli, D. Progetti educativi, informatica e didattica della chimica. Come incoraggiare lo sviluppo della capacità di astrazione negli alunni delle scuole secondarie di primo grado con l'ausilio di applicazioni interattive, Tesi magistrale, (Domenici, V.; Milazzo, P. relatori), Università di Pisa, 2016.
(3) Lischi, G. Sviluppo di un'applicazione ibrida per l'insegnamento del modello particelle nelle scuole secondarie di primo grado, Tesi magistrale, (Domenici, V.; Milazzo, P. relatori), Università di Pisa, 2017.
(4) Link al sito didattico sul modello particellare: http://pages.di.unipi.it/milazzo/modelloparticellare/
(5) Link al video introduttivo sui cristalli liquidi: https://www.youtube.com/watch?v=Sg6FY90PtGY.
(6) Marchetti, A.; Domenici, V. I cristalli liquidi: una introduzione critica. Parte I. La Chimica nella Scuola 2010, IV, 131.
(7) Marchetti, A.; Domenici, V. I cristalli liquidi: una introduzione critica. Parte II. La Chimica nella Scuola 2011, I, 3.
(8) Reinitzer, F.Beiträge zur Kenntnis des Cholesterins, Monatshefte für Chemie 1888, 9, 421.
(9) Lehmann, O. Über fliessende Krystalle. Zeitschrift für Physikalische Chemie 1889, 4, 462.
(10) Johnstone, A. T. The development of chemistry teaching: A changing response to changing demand. Journal of Chemical Education, 1993, 70, 701.
(11) Kumar, S. Liquid Crystals. Cambridge University Press, Cambridge: 2001.
(12) Domenici, V. Ordine, disordine e… la complessità del mondo parzialmente ordinato tra aspetti chimico-fisici e applicazioni tecnologiche. La Chimica e l'Industria 2019, III (5), 54.
(13) Whitmore Smith, A. John Tyndall (1820-1893). The Scientific Monthly (American Association for the Advancement of Science), 1920, 11, 331.
(14) Domenici, V.; Dierking, I. Science for the small and the tall, the young and the old. Liquid Crystals 2018, 27 (1), 2.



