Articolo di Giuseppe Fulvetti
Viene qui presentato il concetto di attivazione asimmetrica di leganti biarilici flessibili nel contesto della sintesi organica, con alcuni tra gli esempi più noti in letteratura. Questo metodo consente di superare l’impiego dei classici leganti statici nell’ambito della catalisi asimmetrica, consentendo l’impiego di miscele raceme.
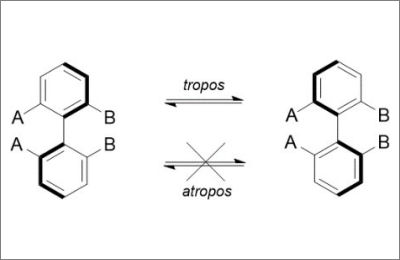
Il termine “atropisomerismo” (dal greco, a = non e tropos = girare) è stato introdotto per la prima volta da Kuhn nel 1933,1 per definire l’isomeria causata dalla impossibilità di rotazione intorno ad un legame singolo, inizialmente riferito ai soli composti biarilici. In particolare, tali sistemi ammettono “chiralità assiale” quando hanno un asse di rotazione stabile che presenta da entrambi i lati sostituenti differenti.
Ciò che consente di isolare e separare due specie atropisomeriche è la velocità di rotazione attorno a questo asse. Nell’operazione gioca un ruolo fondamentale l’ingombro sterico dei sostituenti: biarili con gruppi ingombranti avranno una velocità di isomerizzazione molto più bassa rispetto a quelli con un minor ingombro sterico. La rotazione attorno all’asse atropisomerico è inoltre un processo fortemente dipendente dalla temperatura: composti biarilici scarsamente ingombrati possono risultare completamente bloccati se raffreddati a temperature sufficientemente basse. Al contrario, specie atropisomeriche stabili a temperatura ambiente possono invece isomerizzare se riscaldate ad alte temperature. In questo contesto, è possibile pertanto definire atropisomeri due specie che, ad una data temperatura, hanno un tempo di dimezzamento τ di almeno 1000 s (16.7 min)2. Quando il processo di isomerizzazione avviene troppo velocemente per isolare le due forme enantiomeriche, la molecola viene definita tropos (Figura 1).
Figura 1: Sistemi tropos
Applicazioni in sintesi organica di sistemi tropos
Questi sistemi hanno riscosso particolare interesse nell’ambito della sintesi organica, specialmente in catalisi asimmetrica, quella branca della chimica sintetica che si occupa di ottenere molecole otticamente attive mediante processi catalitici a stereochimica controllata. Il minimo comune denominatore di tutti questi processi è l’impiego di un metallo in combinazione con dei leganti chirali, in grado di direzionare preferenzialmente la trasformazione del substrato verso uno specifico enantiomero del prodotto: tale processo è definito induzione asimmetrica. L’approccio classico in catalisi asimmetrica prevede l’impiego del legante chirale come enantiomericamente puro. Un composto tropos non può essere pertanto utilizzato tal quale come ausiliario chirale in catalisi asimmetrica, dal momento che esiste soltanto in miscela racema; l’unica soluzione è quella di cercare di spostare l’equilibrio verso una delle due specie enantiomeriche. Questo concetto è quello che viene definito “attivazione asimmetrica di leganti tropos” ed è stato introdotto per la prima volta verso la fine degli Anni ’90 da Mikami.3 Negli anni successivi sono state sviluppate diverse strategie per attivare sistemi biarilici flessibili, al fine di studiarne le potenzialità in catalisi asimmetrica e sostituire i più classici leganti chirali atropoisomerici. Ognuna di queste si basa, tuttavia, sullo stesso concetto chiave: la capacità di una specie enantiomericamente pura di trasferire la sua chiralità al sistema tropos.
Attivazione asimmetrica mediante complessazione al centro metallico
Una delle prime strategie, sviluppata dallo stesso Mikami, prevedeva l’attivazione mediante la complessazione ad un centro metallico, a sua volta coordinato ad un legante chirale enantiomericamente puro, detto “attivatore chirale”. In questo caso, il processo può avvenire attraverso due meccanismi principali: attivazione selettiva e attivazione non selettiva.
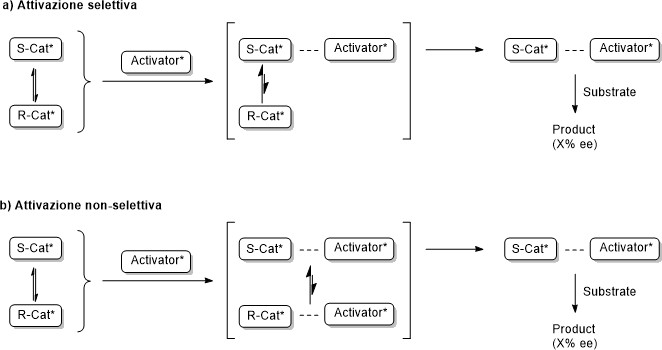
Schema 1: Attivazione asimmetrica di un catalizzatore tropos.
Nel primo caso (Schema 1a), il meccanismo viene detto selettivo poiché l’attivatore reagisce esclusivamente con uno dei due enantiomeri a dare il complesso cataliticamente attivo. In questo modo si genera un eccesso dell’enantiomero non reattivo, che racemizza (vista la natura tropos del sistema) rigenerando l’enantiomero più sensibile all’attivatore, con cui si complessa nuovamente. Grazie a questa serie di equilibri, il bilancio netto sarà dunque la formazione esclusiva di una sola specie diastereoisomerica, cataliticamente attiva. Si parla invece di attivazione non-selettiva (Schema 1b) quando l’attivatore interagisce con entrambi gli enantiomeri tropos a dare una miscela di due diastereoisomeri. Questi, essendo di energia diversa, sono coinvolti in un equilibrio che porta alla formazione preferenziale della specie termodinamicamente più stabile.
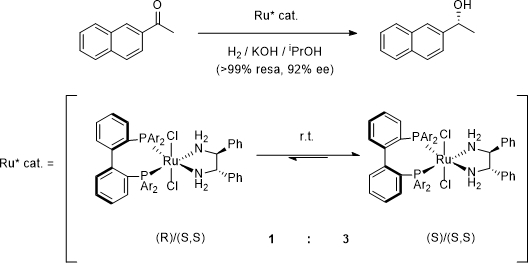
Figura 2: Idrogenazione asimmetrica che impiega una miscela racema di XylBIPHEP-RuCl2 come catalizzatore.
In letteratura sono riportati numerosi esempi in cui viene applicata questa strategia per attivare miscele raceme di leganti flessibili, spesso generando sistemi catalitici più efficienti in termini di induzione asimmetrica rispetto agli analoghi sistemi atropos. Uno dei primi esempi4 è costituto dall’idrogenazione Ru-catalizzata dell’acetonaftone, in presenza di XylBIPHEP-RuCl2 (2,2’-[(3,5-dimetilfenil)-fosfanil]bifenil) come sistema tropos e la (S,S)-DPEN (1,2-difeniletilendiaminna) come attivatore chirale (Figura 2), che fornisce il prodotto con un eccesso enantiomerico del 92%. Questi sistemi sono ampiamente utilizzati non solo in reazioni di riduzione, ma anche in reazioni pericicliche come Diels-Alder ed ene-carbonile asimmetriche.
Attivazione asimmetrica mediante formazione di legami covalenti
Un approccio leggermente differente rispetto al precedente è quello che viene definito come “controllo diastereoisomerico dei leganti tropos”5 (Schema 2). Questo si basa sull’utilizzo di gruppi chirali enantiomericamente puri, legati covalentemente al legante bifenilico flessibile, in modo da favorire la formazione di un diastereoisomero rispetto all’altro.
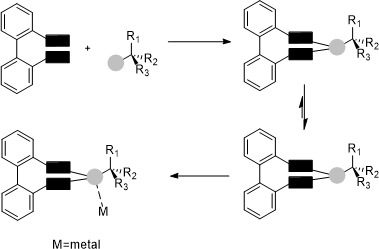
Schema 2: Controllo diastereoisomerico dei leganti tropos.
Questa strategia è stata usata per la prima volta nel 1999,6 dove l’1,4:3,6-dianidro-D-mannosio (comunemente noto come isomannide) è stato usato come unità per il trasferimento della chiralità ad un bifenilfosfito flessibile. Tale sistema è stato poi impiegato nell’idrogenazione asimmetrica del dimetilitaconato, ottenendo il prodotto con un eccesso enantiomerico superiore al 98% (Figura 3).
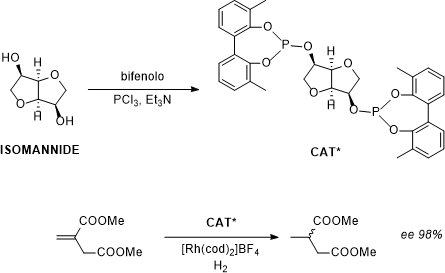
Figura 3: Idrogenazione asimmetrica del dimetilitaconato con un legante chirale a base di isomannide.
In generale, in questo tipo di approccio l’attivatore chirale viene comunemente scelto dal pool chirale, cioè quell’insieme di molecole enantiomericamente pure di origine naturale, disponibili in commercio a basso costo. Tra i composti più usati si trovano alcoli derivanti da terpeni7 e sistemi furanosidici derivanti dalla D-glucosammina e D-glucitolo (Figura 4).
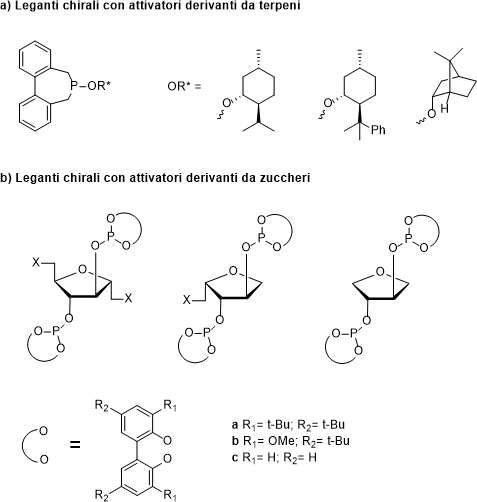
Figura 4: Esempi di leganti chirali tropos, attivati con molecole appartenenti al pool chirale.
Conclusione
Il testo discute l'efficacia, nell’ambito della sintesi organica, della strategia di attivazione asimmetrica che utilizza catalizzatori racemici e leganti tropos (chiralmente flessibili). Questo approccio permette di ottenere prodotti non racemici attivando selettivamente uno degli enantiomeri dei catalizzatori. Questi sistemi tropos risultano più efficienti ed economicamente vantaggiosi rispetto ai leganti atropos, portando a diastereoisomeri termodinamicamente più favorevoli e con una maggiore efficienza chirale. Un ulteriore vantaggio dei leganti tropos è quello di ridurre gli sprechi dovuti all’impiego di sistemi atropos, poiché in questo caso gli enantiomeri meno attivi vengono inutilizzati. La natura del catalizzatore attivato, tropos o atropos, può essere controllata combinando vari centri metallici e attivatori chirali. Per concludere, l'attivazione asimmetrica dei sistemi tropos rappresenta un'importante innovazione nella sintesi asimmetrica, poiché rappresenta un cambiamento di paradigma rispetto all'uso tradizionale dei leganti atropos.
Riferimenti
(1) Goldschmidt, S. Stereochemie; Hand- und Jahrbuch der chemischen Physik; Akademische Verlagsgesellschaft, 1933.
(2) Ōki, M. Recent Advances in Atropisomerism. In Topics in Stereochemistry; Topics in Stereochemistry; 1983; pp 1–81. https://doi.org/10.1002/9780470147238.ch1
(3) Mikami, K.; Korenaga, T.; Matsumoto, Y.; Ueki, M.; Terada, M.; Matsukawa, S. Racemic Catalysis through Asymmetric Activation*; 2001; Vol. 73.
(4) Mikami, K.; Korenaga, T.; Terada, M.; Ohkuma, T.; Pham, T.; Noyori, R. Conformationally Flexible Biphenyl-Phosphane Ligands for Ru-Catalyzed Enantioselective Hydrogenation. Angewandte Chemie International Edition 1999, 38 (4), 495–497. https://doi.org/10.1002/(SICI)1521-3773(19990215)38:4<495::AID-ANIE495>3.0.CO;2-O
(5) Muñiz, K.; Bolm, C. Configurational Control in Stereochemically Pure Ligands and Metal Complexes for Asymmetric Catalysis. Chemistry - A European Journal 2000, 6 (13), 2309–2316. https://doi.org/10.1002/1521-3765(20000703)6:13<2309::AID-CHEM2309>3.0.CO;2-N
(6) Reetz, M. T.; Neugebauer, T. New Diphosphite Ligands for Catalytic Asymmetric Hydrogenation: The Crucial Role of Conformationally Enantiomeric Diols. Angewandte Chemie International Edition 1999, 38 (1–2), 179–181. https://doi.org/10.1002/(SICI)1521-3773(19990115)38:1/2<179::AID-ANIE179>3.0.CO;2-Z
(7) Zalubovskis, R.; Fjellander, E.; Szabó, Z.; Moberg, C. Stereochemical Control of Chirally Flexible Phosphepines. European J Org Chem 2007, 2007 (1), 108–115. https://doi.org/10.1002/ejoc.200600717



