Articolo divulgativo in Stereochimica di Gennaro Pescitelli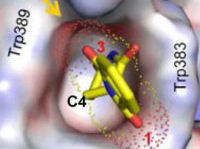 Prendendo spunto dalla “tragedia della talidomide”, si illustrano quattro concetti di stereochimica: (1) la diversa attività biologica degli stereoisomeri; (2) la racemizazione di composti chirali con centri stereogenici labili; (3) la dipendenza delle proprietà chimico-fisiche dalla composizione enantiomerica; (4) il fenomeno dell’auto-disproporzionamento degli enantiomeri dovuto a precipitazione preferenziale del composto racemo.
Prendendo spunto dalla “tragedia della talidomide”, si illustrano quattro concetti di stereochimica: (1) la diversa attività biologica degli stereoisomeri; (2) la racemizazione di composti chirali con centri stereogenici labili; (3) la dipendenza delle proprietà chimico-fisiche dalla composizione enantiomerica; (4) il fenomeno dell’auto-disproporzionamento degli enantiomeri dovuto a precipitazione preferenziale del composto racemo.
Introduzione
La talidomide è uno dei farmaci più tristemente famosi della farmacopea mondiale, al centro di una delle più gravi tragedie della medicina negli anni ’50 ma anche uno dei farmaci che più ha contribuito alla nascita delle regolamentazioni in campo farmaceutico. Prescritta come sedativo e antinausea alle donne in gravidanza, causò a cavallo tra gli anni ’50 e ’60 la nascita in vari paesi di oltre 10'000 neonati affetti da malformazioni, soprattutto agli arti, alle orecchie e agli organi interni; circa la metà di essi non sopravvisse.1
La talidomide (Schema 1) possiede un centro stereogenico in posizione 3’ dell’anello della glutarimmide. Il farmaco fu commercializzato dalla Chemie Grünenthal GmbH come racemato. Gli aspetti legati alla stereochimica della molecola e il loro impatto sulle proprietà biologiche e farmaceutiche offrono lo spunto per trattare diversi argomenti di stereochimica, che possiamo suddividere in quattro lezioni.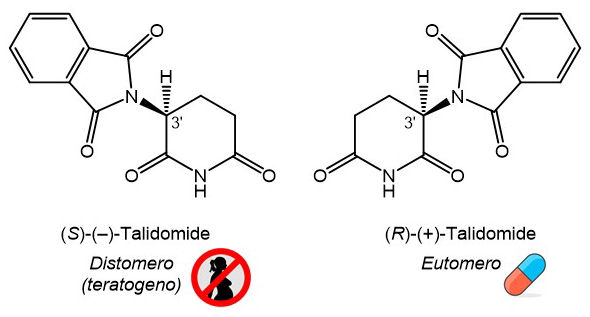
Schema 1.
Discussione
Lezione 1: stereochimica e attività farmacologica
Circa vent’anni dopo la tragedia della talidomide, Blaschke e collaboratori scoprirono che il solo enantiomero (S)-(–) esercita attività teratogena negli animali (topi e ratti).2 Che isomeri diversi di una molecola (enantiomeri e diastereomeri) siano associati in generale a diverse attività biologiche e farmacologiche è una nozione ormai assodata.3 Ciò è dovuto al fatto che gli isomeri interagiscono differentemente con recettori, proteine di trasporto, membrane etc. degli organismi viventi, e presentano quindi diversa attività farmacologica, diversi parametri farmacocinetici (parametri ADME: assorbimento, distribuzione, metabolismo, escrezione), e diversa tossicità. L’attività desiderata è di solito associata a un singolo isomero, detto eutomero: nel caso della talidomide, esso corrisponde all’enantiomero (R)-(+) (Schema 1). Gli altri isomeri sono detti distomeri, e possono essere meno attivi, totalmente inattivi, o agire da antagonisti dell’eutomero, o avere effetti tossici. È appunto questo il caso dell’enantiomero (S)-(–) della talidomide. Nel 2010 Handa e collaboratori identificarono nella proteina cereblon (CRBN) il target primario della talidomide quando essa esplica attività teratogena.3 In seguito al legame, viene inibita l’attività proteica funzionale al normale sviluppo del feto, da cui la teratogenesi. Da studi di cristallografia a raggi X sul complesso CRBN/talidomide è emerso che i due enantiomeri occupano il sito di legame assumendo conformazioni differenti; in particolare la molecola di (R)-talidomide è forzata ad assumere una conformazione distorta ad alta energia, che ne spiega la minore affinità (circa un ordine di grandezza) per CRBN rispetto all’isomero (S) (Figura 1).4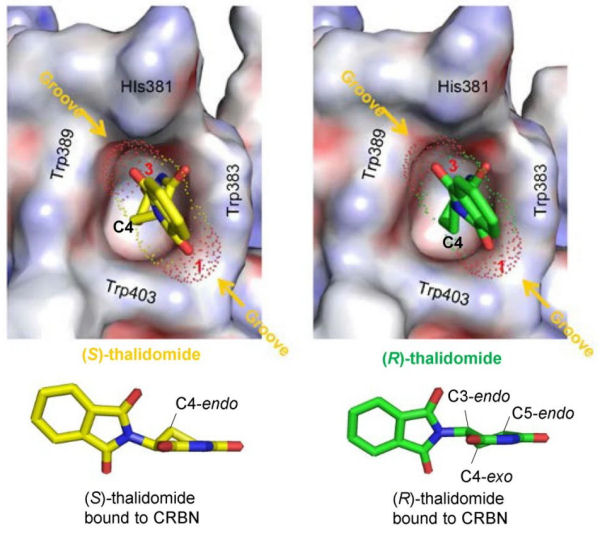
Figura 1. Binding di (S)-(–) e (R)-(+)-talidomide nel sito di legame di CRBN.
Riadattata da Mori et al.4 in base alla Creative Commons Attribution 4.0 International License.
Poiché l’attività teratogena della talidomide è associata all’enantiomero (S), è lecito domandarsi se la somministrazione del solo enantiomero (R) – anziché del racemato – avrebbe potuto evitare la tragedia degli anni ’50.
Lezione 2: racemizzazione di composti chirali
Il centro stereogenico in posizione 3’ della talidomide corrisponde ad un carbonio secondario in α al gruppo carbonilico ed è quindi soggetto ad enolizzazione (Schema 2). Tale fenomeno si accompagna necessariamente alla racemizzazione del substrato, così come accade per tutti i composti carbonilici con centri stereogenici in posizione α. Da un punto di vista termodinamico, qualsiasi fenomeno di racemizzazione è sempre favorito, irreversibile e controllato dall’entropia:![]()
Durante la racemizzazione (formazione di un racemo da un composto enantiopuro), il numero di microstati Ω raddoppia, quindi ΔG0=–0.41 kcal/mol a 300K. L’unico ostacolo alla racemizzazione è dunque cinetico. Il tempo di semi-vita di racemizzazione τ1/2 è definito come il tempo necessario a dimezzare l’eccesso enantiomerico (ee) di un composto.5
La talidomide è strutturalmente simile a un derivato α-amminoacidico. La racemizzazione degli α-amminoacidi è lenta in acqua ma catalizzata da acidi e basi e favorita dalla presenza di gruppi derivatizzanti alle due unità acida e amminica. È interessante sapere che il grado di racemizzazione degli amminoacidi all’interno di campioni fossili è utilizzato come mezzo di datazione (cosiddetta tecnica amino acid racemization, AAR).6 La talidomide racemizza in vitro (in funzione del pH) e in vivo con tempi τ1/2 di 1-10h.7 Com’è allora possibile che l’attività biologica, tanto terapeutica quanto teratogena, sia diversa per i due enantiomeri? Questa domanda costituisce il cosiddetto “paradosso della talidomide”.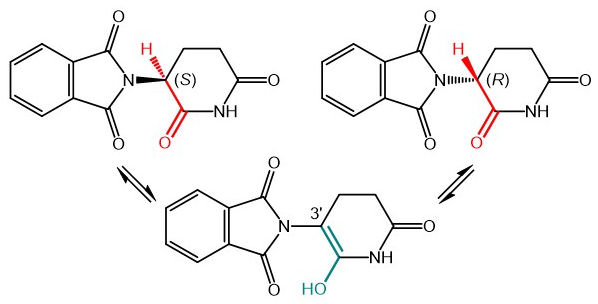
Shema 2.
Lezione 3: discriminazione di enantiomeri
È nozione comune che i due enantiomeri di una sostanza chirale posseggono identiche proprietà chimico-fisiche eccetto per quelle chirottiche, come la rotazione ottica. Una seconda nozione, altrettanto importante, è che tutte le proprietà delle sostanze chirali dipendono dalla loro composizione enantiomerica. In particolare, si ravvisano spesso differenze sostanziali tra i due composti enantiopuri e la loro miscela racema. Una lista parziale di tali proprietà include le forme cristalline, la densità dei cristalli, il punto di fusione, la solubilità, la tensione di vapore, le proprietà alle interfacce, spettri di varia natura, e così via. Il motivo di tali differenze è da ravvisare nel fatto che le interazioni omochirali, ovvero tra molecole di una specie chirale con la stessa configurazione, differiscono dalle interazioni eterochirali, ovvero tra molecole di una specie chirale con configurazione opposta (Figura 2).5 Tale differenza è una manifestazione della discriminazione enantiomerica, un fenomeno che ha conseguenze soprattutto allo stato solido, laddove spesso si osserva che i cristalli dei composti racemi sono più densi, più alto-fondenti e meno solubili dei cristalli dei corrispondenti enantiomeri (regola di Wallach).8 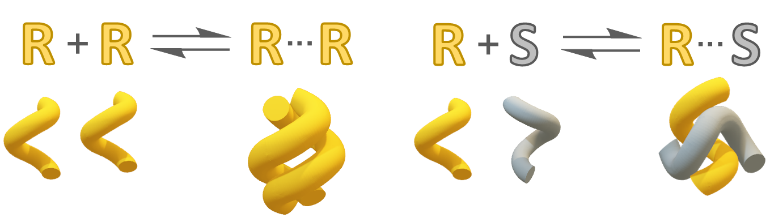
Figura 2. Interazioni omochirali ed eterochirali schematizzate per un dimero. In generale, si osserva che ![]() e in molti casi
e in molti casi ![]() (con energie libere negative).
(con energie libere negative).
La regola di Wallach vale anche per la talidomide. Il composto enantiopuro cristallizza nel gruppo di simmetria P21 formando cristalli con densità di 1.427 g/cm–3 che fondono a 240°C. Il composto racemo cristallizza nel gruppo di simmetria P21/n formando cristalli con densità di 1.455 g/cm–3 che fondono a 271°C. La solubilità in acqua del composto enantiopuro è circa 5.5 volte maggiore di quella del racemato (circa 350 μg/ml contro 60 μg/ml).9 Analizzando le due strutture cristalline, si nota in particolare come i legami idrogeno tra gruppi immidici all’interno dei dimeri siano più forti nel caso del composto racemo, grazie a caratteristiche strutturali più favorevoli: i gruppi O=C–N–H sono praticamente coplanari nel racemato mentre formano un angolo di circa 15° nel composto enantiopuro (Figura 3). Nel primo caso, i legami idrogeno sono leggermente più corti; il dimero eterochirale risulta più stabile di circa 1 kcal/mol, secondo calcoli DFT.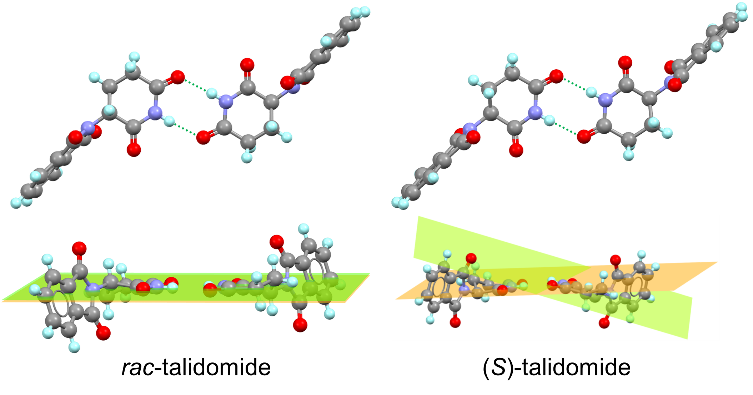
Figura 3. Dimeri etrochirali e omochirali all’interno delle strutture cristalline di rac-talidomide (depositata con CCDC 1009508) e (S)-talidomide (CCDC 1009509).
Lezione 4: auto-disproporzionamento degli enantiomeri
Una delle conseguenze della discriminazione enantiomerica è il fenomeno dell’auto-disproporzionamento degli enantiomeri (self-disproportionation of enantiomers, SDE). Con tale termine si intende la variazione della composizione enantiomerica di una miscela non racema di enantiomeri (miscela scalemica) in seguito a precipitazione preferenziale del composto racemo, che, come abbiamo visto, risulta spesso meno solubile. Per semplicità, immaginiamo di operare in condizioni in cui il composto racemo sia completamente insolubile mentre il composto solido enantiopuro sia solubile: ciò condurrà all’arricchimento enantiomerico fino a trasformazione della miscela scalemica in un composto enantiopuro in soluzione (Figura 4a). Qualora la miscela scalemica sia stata ottenuta in seguito a parziale racemizzazione del composto enantiopuro, l’auto-disproporzionamento finisce per ripristinare la purezza enantiomerica iniziale (Figura 4b).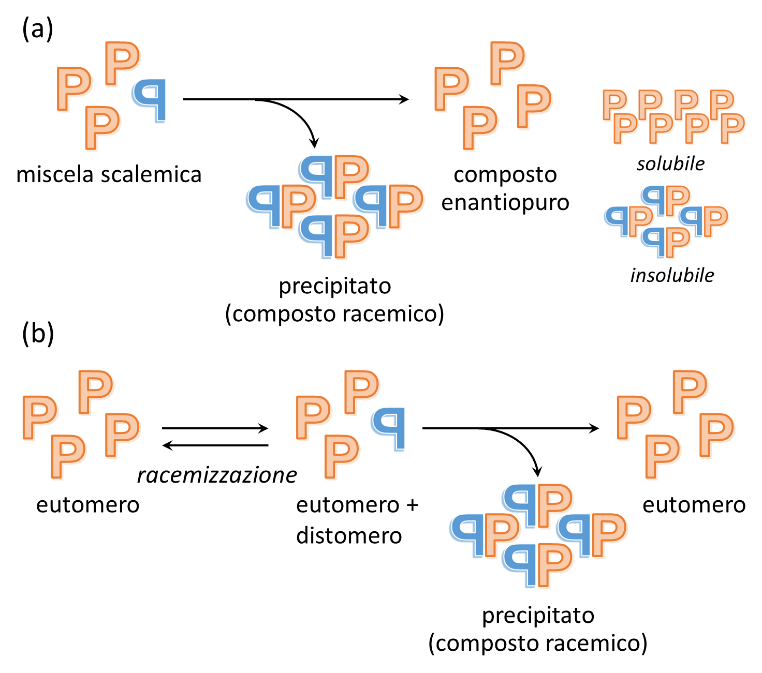
Figura 4. (a) Schematizzazione del fenomeno SDE. (b) Conseguenze dell’accoppiamento tra racemizzazione e SDE per un farmaco chirale.
Nel 2018, Shibata e collaboratori hanno dimostrato che la talidomide dà luogo a SDE in diversi solventi organici e in acqua.11 Sciogliendo 5 mg di una miscela scalemica di (S)/(R)-talidomide 2:3 (ee 20%) in acqua e filtrando dopo un’ora, la talidomide rimasta in soluzione ha un ee del 97-98%. Su scala maggiore (50 mg) vicina alla dose terapeutica, dopo un’ora si recupera il 7-9% di talidomide nel filtrato, con un ee del 72-74%.
Pertanto, assumendo che l’SDE si verifichi anche in condizioni fisiologiche, il paradosso della talidomide può essere così spiegato: una volta somministrato, l’eutomero (R)-talidomide racemizza, formando gradualmente una miscela scalemica comunque arricchita nell’enantiomero (R). Tale miscela scalemica dà luogo a SDE formando un precipitato racemo che viene escreto dall’organismo, mentre l’eutomero sopravvive nel fluido biologico raggiungendo poi le cellule bersaglio.
Conclusioni
Combinando diverse nozioni di stereochimica è possibile spiegare il “paradosso della talidomide” come segue: (1) delle due forme isomeriche della talidomide, l’azione teratogena è esercitata preferenzialmente dall’enantiomero (S); (2) i due enantiomeri interconvertono in vivo; (3) il composto racemo ha solubilità minore dei composti enantiopuri; (4) per questo motivo, una miscela scalemica di talidomide si arricchisce spontaneamente dell’enantiomero presente in quantità maggiore. Pertanto, somministrando il solo eutomero, malgrado la sua parziale racemizzazione, esso raggiungerà preferenzialmente il suo target biologico, mentre il distomero verrà escreto sotto forma di racemato. Si può perciò ipotizzare che la tragedia della talidomide avrebbe potuto avere esiti meno drammatici somministrando il solo enantiomero (R) come farmaco sedativo e antinausea. Di questa ipotesi mancano tuttavia prove biologiche definitive, come sottolineato negli anni dai chimici della Grünenthal.12
Ringraziamenti
Ringrazio il prof. Lorenzo Di Bari per i suoi preziosi suggerimenti.
Riferimenti
(1) Hoffmann, R. La Chimica allo Specchio. Longanesi, Milano, 2006.
(2) Blaschke, G. et al. Chromatographic separation of racemic thalidomide and teratogenic activity of its enantiomers. Arzneim.-Forsch. 1979, 29, 1640–1642.
(3) Smith, S.W. Chiral Toxicology: It's the Same Thing… Only Different. Toxicol. Sci., 2009, 110, 4–30.
(4) Ito, T. et al. Teratogenic effects of thalidomide: molecular mechanisms. Cell. Mol. Life Sci. 2011, 68, 1569-1579.
(5) Mori, T. et al. Structural basis of thalidomide enantiomer binding to cereblon. Sci. Rep. 2018, 8, 1294.
(6) Eliel, E.L.; Wilen, S.H.; Doyle, M.P. Basic Organic Stereochemistry. Wiley-Interscience, New York, 2011.
(7) Bravenec, A. D. et al. Amino acid racemization and its relation to geochronology and archaeometry. J. Sep. Sci. 2018, 41, 1489-1506.
(8) Eriksson, T. et al. Stereospecific determination, chiral inversion in vitro and pharmacokinetics in humans of the enantiomers of thalidomide. Chirality, 1995, 7, 44-52.
(9) Pratt Brock, C. et al. On the validity of Wallach's rule: on the density and stability of racemic crystals compared with their chiral counterparts. J. Am. Chem. Soc. 1991, 113, 9811-9820.
(10) Suzuki, T. at al. Evaluation of stability difference between asymmetric homochiral dimer in (S)-thalidomide crystal and symmetric heterochiral dimer in (RS)-thalidomide crystal. Phase Transit. 2010, 83, 223-234.
(11) Tokunaga, E. et al. Understanding the Thalidomide Chirality in Biological Processes by the Self-disproportionation of Enantiomers. Sci. Rep. 2018, 8, 17131.
(12) Winter, W.; Frankus, E. Thalidomide enantiomers. Lancet 1992, 339, 365.



