Articolo divulgativo in Chimica Analitica di Alessio Lenzia Lo scompenso cardiaco è una condizione patologica che si sviluppa quando il cuore non pompa abbastanza sangue per i bisogni del corpo. I peptidi natriuretici sono biomarcatori cardiospecifici e sensibili normalmente utilizzati per la sua diagnosi e per il suo monitoraggio. Il loro dosaggio nel sangue è comunemente effettuato mediante kit immunoenzimatici che, tuttavia, presentano problematiche dovute ad un'elevata reattività crociata con specie strutturalmente simili.
Lo scompenso cardiaco è una condizione patologica che si sviluppa quando il cuore non pompa abbastanza sangue per i bisogni del corpo. I peptidi natriuretici sono biomarcatori cardiospecifici e sensibili normalmente utilizzati per la sua diagnosi e per il suo monitoraggio. Il loro dosaggio nel sangue è comunemente effettuato mediante kit immunoenzimatici che, tuttavia, presentano problematiche dovute ad un'elevata reattività crociata con specie strutturalmente simili.
La ricerca descritta nel presente articolo ha lo scopo di sviluppare un approccio analitico per la determinazione di peptidi natriuretici nel plasma umano, che prevede l’utilizzo di una tecnica di microestrazione tramite adsorbente impaccato seguita dall’analisi in cromatografia liquida accoppiata alla spettrometria di massa tandem.
Introduzione
Il sangue è un fluido presente negli animali dotati di apparato circolatorio, quindi anche nell'uomo; esso ha colore rosso (quello più chiaro è arterioso, quello più scuro venoso) e sapore ferroso, dovuto alla presenza del metallo in forma ossidata. Assolve numerose funzioni essenziali, in primo luogo il trasporto di ossigeno e nutrienti alle cellule dell'organismo e la parallela rimozione da esse di anidride carbonica ed altri metaboliti. Il sangue è composto da cellule specializzate e da una matrice extracellulare liquida, detta plasma, che gli conferisce le caratteristiche di fluido non newtoniano, ossia un fluido la cui viscosità varia a seconda dello sforzo di taglio che viene applicato. Di conseguenza, i fluidi non newtoniani non hanno un valore definito di viscosità.
Il plasma sanguigno contiene proteine, nutrienti, prodotti del metabolismo, ormoni ed elettroliti inorganici, ma è privo di cellule. È composto principalmente da acqua (92%), proteine (8%) e sali minerali. Serve come mezzo di trasporto per il glucosio, i lipidi, ormoni, i prodotti del metabolismo, anidride carbonica e ossigeno. Il plasma è il mezzo di immagazzinamento e trasporto dei fattori della coagulazione, quali la fibrina, e il suo contenuto di proteine è necessario per mantenere la pressione osmotica del sangue. L’insieme delle proteine plasmatiche è generalmente quello più informativo dal punto di vista clinico. Il plasma è un campione molto complesso che contiene proteine in una vasta gamma di concentrazioni (da unità di pg/mL a decine di mg/mL) e di pesi molecolari (1 – 100 kDa)1. La frazione più interessante è senz’altro quella a basso peso molecolare (<30kDa), costituita da proteine e peptidi che hanno una notevole importanza dal punto di vista fisiologico2.
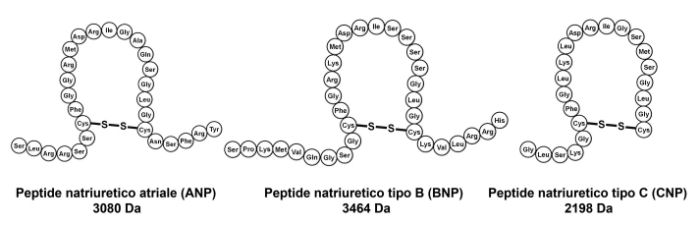
Tuttavia, la quantificazione di questi analiti tramite spettrometria di massa è complicata a causa della loro bassa concentrazione (pg/mL) e per la presenza di proteine abbondanti come l’albumina e le immunoglobuline (decine di mg/mL). Per questo motivo è sempre necessario durante la procedura di trattamento del campione di plasma rimuovere le proteine più abbondanti e, allo stesso tempo, procedere ad un “arricchimento” delle proteine di interesse mediante avanzate tecniche analitiche3. I peptidi natriuretici (NPs) sono una famiglia di ormoni sintetizzati dai cardiomiociti, cellule che hanno la funzione di mantenere l’omeostasi nel sistema cardiovascolare4. Gli NPs sono sintetizzati come pro-ormoni e, una volta rilasciati nel flusso sanguigno, scissi proteoliticamente in diversi frammenti biologicamente attivi5 (Schema 1).
In base al pro-ormone che li ha generati, i piccoli frammenti prenderanno il nome, rispettivamente, di peptide natriuretico atriale (ANP 1-28), peptide natriuretico tipo B (BNP 1-32) e peptide natriuretico tipo C (CNP 1-22).
In condizioni patologiche come lo scompenso cardiaco, il cuore può indurre lo stiramento dei cardiomiociti a causa del sovraccarico di pressione, portando al rilascio degli NPs nel sangue.
Schema 1.
Questa caratteristica li rende i principali biomarcatori monitorati a livello clinico per la prognosi e la diagnosi dello scompenso cardiaco6. I livelli di concentrazione degli NPs nel sangue si aggirano intorno alle decine o centinaia di pg/mL ed il loro dosaggio viene normalmente effettuato utilizzando dei test immunoenzimatici7. Sfortunatamente, questo approccio può essere affetto da reazioni crociate dovute alla presenza di specie omologhe (non biologicamente attive) prodotte dalla degradazione proteolitica dei peptidi biologicamente attivi, causando problemi di specificità del test. Ad esempio, le forme degradate del BNP 1-32, denominate come BNP 3-32 (perdita del dipeptide Ser-Pro) e BNP 5-32 (perdita del tetrapeptide Ser-Pro-Lys-Met), possiedono strutture molecolari omologhe8, interferendo con la quantificazione del peptide biologicamente attivo mediante immunodosaggio9 (Figura 1).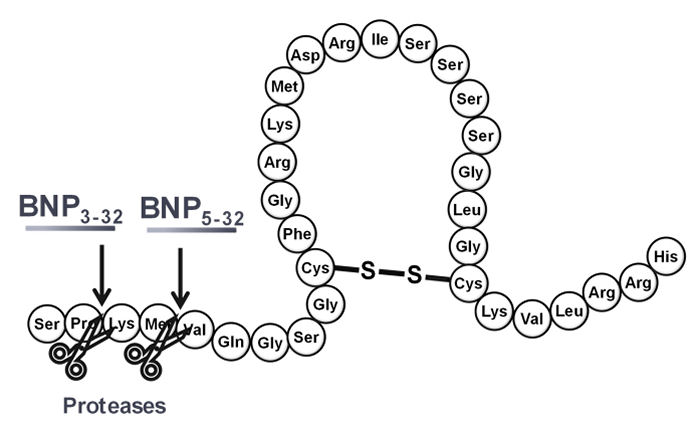
Figura 1. Posizioni nelle quali avviene la degradazione proteolitica nel peptide BNP 1-32. Ogni sfera della catena rappresenta una unità amminoacidica.
Per di più, test diversi possiedono diversi valori soglia per gli NPs che permettano di escludere la presenza di HF da un paziente. Infatti, la mancata armonizzazione tra test commercialmente disponibili di produttori diversi, rende difficoltoso il confronto dei dati ottenuti con test diversi8.
Pertanto, l’obiettivo di questa ricerca è lo sviluppo di una procedura analitica per la determinazione simultanea di diverse forme di NPs nel plasma umano basata su una tecnica di micro-estrazione tramite adsorbente impaccato (MEPS) e cromatografia liquida accoppiata alla spettrometria di massa tandem (UHPLC-MS/MS).
Sviluppo del metodo UHPLC-MS/MS
La cromatografia liquida (LC) è considerata attualmente la tecnica di elezione per l'analisi di peptidi e proteine, soprattutto per la sua capacità di separare specie di struttura quasi identica10. Ad esempio, dalla Figura 2 si può constatare come specie strutturalmente molto simili come il BNP 1-32 e le sue forme degradate BNP 3-32 e BNP 5-32 che differiscono solamente di alcuni amminoacidi, risultino cromatograficamente separate.
Cromatografia liquida ad alte prestazioni (HPLC)
La cromatografia è una tecnica analitica che permette la separazione di sostanze presenti in una miscela complessa. In HPLC la separazione fisica dei composti target (o analiti) presenti in un campione liquido avviene utilizzando un flusso di solvente chiamato fase mobile. La fase mobile, grazie alla presenza di una pompa, viene continuamente flussata attraverso una colonna (generalmente un tubo di acciaio), riempita con delle particelle di silice che sono ricoperte da una fase stazionaria. Quando il campione trasportato dalla fase mobile raggiunge la colonna, i suoi componenti possono interagire in maniera più o meno forte con la fase stazionaria a seconda delle loro proprietà chimico-fisiche. Alcuni analiti potranno interagire in misura maggiore rispetto ad altri con la fase stazionaria determinando così la loro separazione. La conseguenza di questo processo è che gli analiti che instaureranno una minore interazione con la fase stazionaria fuoriusciranno per primi dalla colonna, mentre quelli che instaureranno un’interazione più forte fuoriusciranno per ultimi. Il tempo che ciascun analita impiega per percorrere la colonna è caratteristico per ognuno di essi (in determinate condizioni sperimentali) ed è chiamato tempo di ritenzione. Nella figura in basso è riportato lo schema generale di uno strumento HPLC.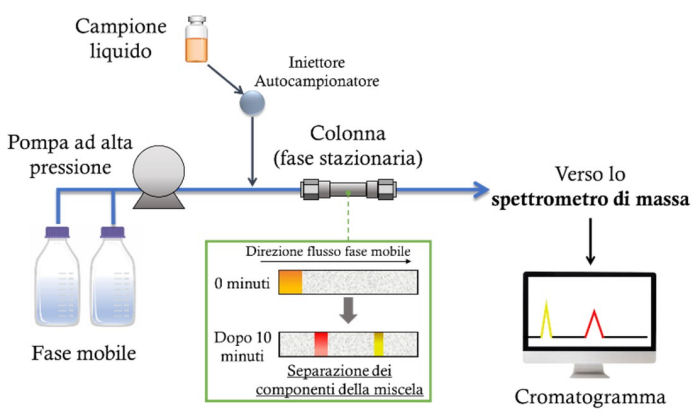
Un cromatogramma è un grafico bidimensionale nel quale sull'asse delle ordinate è riportata la risposta del rivelatore, convertita in un segnale elettrico e sull’asse delle ascisse il tempo di ritenzione. Il rivelatore (nel caso in questione lo spettrometro di massa) fornisce come risposta un picco la cui area sottesa dipende dalla concentrazione del particolare componente del campione.
Ogni picco presente nel cromatogramma corrisponderà ad uno dei componenti del campione analizzato.
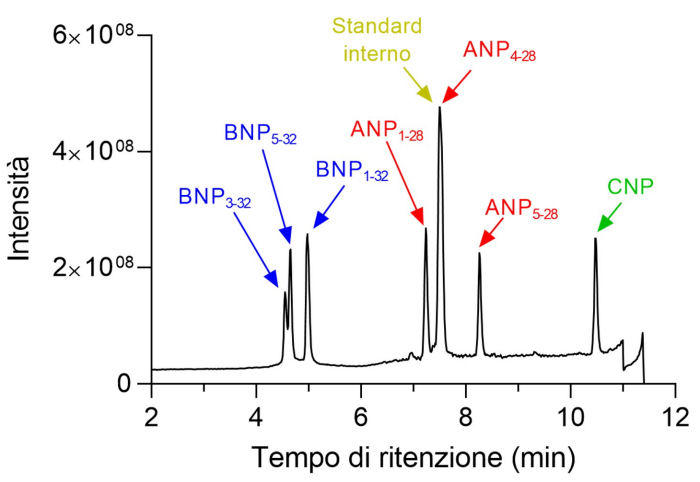
Figura 2. Cromatogramma ottenuto analizzando una soluzione standard di NPs alla concentrazione di 1 μg/mL in modalità “Full Scan”.
Lo sviluppo di un metodo che prevede l’utilizzo di una strumentazione UHPLC-MS/MS include l’ottimizzazione di alcuni parametri, tra cui la tipologia di fase stazionaria, la composizione della fase mobile, i flussi, le temperature di lavoro, così come i parametri della sorgente elettrospray (ESI)a e della rivelazione in MS/MS.
Per i peptidi natriuretici, le migliori condizioni cromatografiche
sono state ottenute utilizzando una colonna Zorbax 300-SB C3 (più polare rispetto ad una classica fase C18), una fase mobile composta da (A) H2O e (B) acetonitrile (ACN) entrambi contenenti lo 0,2 % v/v di acido formico (FA) e lo 0,01 % v/v di alcool 3-nitrobenzilico (3-NBA), con un flusso di 0,4 mL/min ed una temperatura di 50 °C.
Spettrometria di massa
La spettrometria di massa (MS) è una tecnica analitica che consente l’identificazione e l’analisi quantitativa di una molecola e della sua massa. La formazione di ioni dell’analita in fase gassosa è un pre-requisito essenziale per il tipico funzionamento di uno spettrometro di massa dopo la separazione cromatografica. Gli ioni prodotti in una “sorgente” vengono separati all’interno dello spettrometro sulla base del loro rapporto massa/carica (m/z) da un sistema chiamato analizzatore di massa, che costituisce la parte più importante di tutta la strumentazione. Successivamente gli ioni vengono raccolti da un rivelatore generando un segnale elettrico proporzionale al numero di ioni di analita che vi arrivano.
L’acido formico viene abitualmente aggiunto alla fase mobile poiché la sua presenza facilita la protonazione (e quindi la ionizzazione) degli analiti nella sorgente ESI, mentre l’aggiunta di alcool 3-nitrobenzilico ha un’altra funzione. È noto che la concentrazione degli NPs nel plasma sia molto bassa (ordine dei pg/mL) e che, di conseguenza, la sensibilitàb del metodo possa non essere sufficiente per la loro quantificazione e rivelazione. L’aggiunta alla fase mobile di una specifica sostanza chimica, come 3-NBA, denominata “supercharger”, permette di incrementare l’efficienza di ionizzazione dei peptidi all’interno della sorgente ESI11, e quindi la sensibilità del metodo. Come è possibile osservare dalla Figura 3, il risultato è infatti l’aumento del rapporto segnale-rumore (S/N).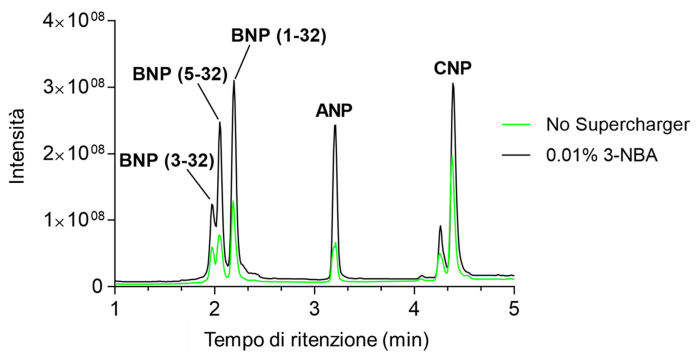
Figura 3. Cromatogramma ottenuto analizzando una soluzione standard 1 μg/mL di NPs senza l’aggiunta di “supercharger” in fase mobile(verde), e con l’aggiunta dello 0.01% v/v di 3-NBA in fase mobile (nero).
Studio della stabilità dei peptidi natriuretici in soluzione acquosa
Peptidi e proteine tendono a subire nel tempo fenomeni di adsorbimento al materiale del contenitore in cui sono conservati e/o tendono a subire fenomeni di ossidazione12. Per questo motivo, è stata studiata la stabilità degli NPs in soluzioni di lavoro (ad una concentrazione di 2 ng/mL) fino a 24 ore a 4 °C.
I migliori risultati sono stati ottenuti utilizzando come solvente di diluizione una soluzione acquosa acidificata (0,2% v/v FA) contenente lo 0,05% m/v di siero albumina umana (HSA) e 45 μg/mL di metionina (Met). Questi additivi hanno lo scopo sia di ridurre l’adsorbimento alle pareti dei contenitori sia di fungere da antiossidanti.
Per studiare l'insorgenza di processi ossidativi, le soluzioni standard di ciascun peptide alla concentrazione di 1 μg/mL (senza additivi) sono state analizzate immediatamente dopo la preparazione (t0), dopodiché i contenitori sono stati mantenuti senza tappo a condizioni ambientali permettendo all'ossigeno di diffondere all'interno e analizzati dopo 24, 36 e 72 ore. La Figura 4 mostra un cromatogramma ottenuto dopo aver sottoposto al processo di ossidazione il peptide BNP 1-32 e l'andamento nel tempo del segnale del BNP 1-32 e delle sue forme ossidate.
Nel caso di peptidi con due metionine come BNP 1-32, sono stati ottenuti sia i composti con una sola metionina ossidata sia quello con entrambe le metionine ossidate (Schema 2).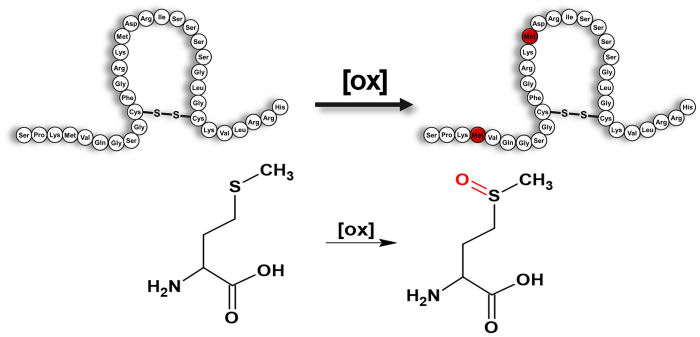
Schema 2.
La metionina ha un gruppo laterale contenente zolfo che è suscettibile all'ossidazione13, ed in particolare, provoca una diminuzione dell'idrofobicità del peptide portando, in LC, ad una sua minore ritenzione su una fase stazionaria idrofobica10.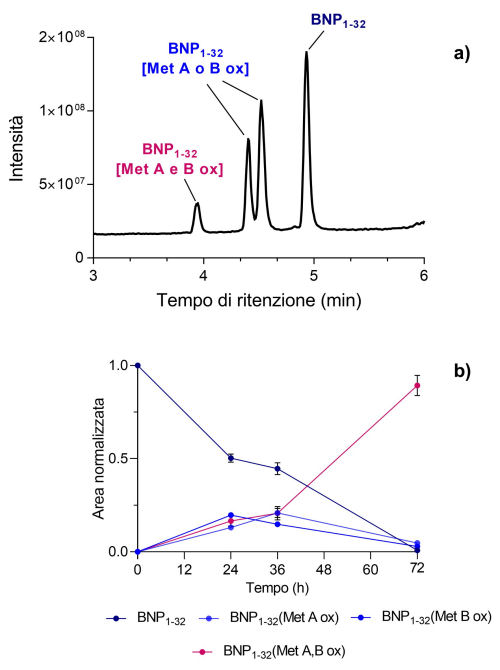
Figura 4. (a) Cromatogramma in “Full Scan” di una soluzione (1 μg/mL) di BNP 1-32 preparata senza l’aggiunta di additivi e analizzata dopo 24 ore di esposizione all'aria a temperatura ambiente. (b) Andamento nel tempo (fino a 72 ore) del segnale del BNP 1-32 e delle sue forme ossidate.
Sviluppo di una procedura di pretrattamento del campione di plasma
Il plasma umano è uno dei fluidi biologici più studiati e quello più utilizzato per la diagnosi delle malattie. Ad esempio, il proteoma plasmatico (ovvero l’insieme delle proteine presenti nel plasma) può essere correlato con specifici stati fisiologici o patologici dell’individuo. Dal punto di vista analitico, la quantificazione di analiti in ultratracce nel plasma è complicata dalla presenza di 10 proteine più abbondanti (circa il 90% del contenuto proteico plasmatico) tra le quali l’albumina e le immunoglobuline, la cui presenza può dar luogo a composti che possono interferire con gli analiti d’interesse.
La precipitazione frazionata delle proteine con (NH4)2SO4 (solfato di ammonio) saturo è considerata una procedura efficace per la rimozione delle proteine più abbondanti dal plasma umano14.
Nel caso degli NPs, un’aliquota da 500 μL di campione di plasma è stata sottoposta ad una precipitazione delle proteine con (NH4)2SO4 fino al raggiungimento del 90% di saturazione in soluzione. Successivamente, gli analiti precipitati sono stati solubilizzati con un solvente organico. Il surnatante è stato evaporato sotto flusso di azoto, ed infine ricostituito in una soluzione acquosa di metionina (45 μg/mL) contenente lo 0,5% v/v di acido trifluoroacetico prima di essere sottoposto alla procedura MEPS. La tecnica MEPS è considerata una miniaturizzazione dell’estrazione in fase solidac (SPE), che ha i vantaggi di pre-concentrare gli analiti e allo stesso tempo rimuovere potenziali interferenti dal campione.
Figura 5. Precipitazione delle proteine plasmatiche con (NH4)2SO4 saturo.
In Figura 6 sono riportati i cromatogrammi di un bianco plasma (campione di plasma privo degli analiti) e quello di un bianco plasma addizionato dei composti target (ad una concentrazione finale di 500 pg/mL) dopo essere stati sottoposti alla procedura di pretrattamento descritta.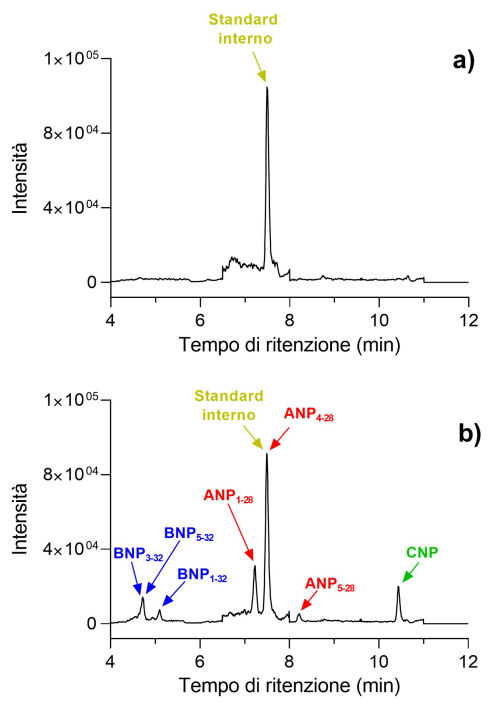
Figura 6. Cromatogrammi ottenuti dall'analisi di (a) un bianco plasma e (b) di un campione di plasma addizionato di tutti gli analiti target (concentrazione finale di 500 pg/mL).
Conclusioni
Il metodo sviluppato consente di monitorare simultaneamente 3 peptidi natriuretici nella loro forma attiva e 4 delle loro forme degradate in campioni di plasma. Considerando inoltre i bassi costi dei reagenti impiegati (ad esempio, solfato di ammonio) e la semplicità della procedura di pretrattamento, questo metodo ha tutte le potenzialità per essere implementato per la determinazione di peptidi natriuretici nel plasma di individui affetti da scompenso cardiaco e per il loro monitoraggio nel tempo.
Ringraziamenti
Ringrazio la Dott.ssa Silvia Ghimenti per il tempo dedicatomi ed i suoi preziosi consigli.
Note
a interfaccia tra sistema HPLC e spettrometro di massa che consente la ionizzazione e il passaggio in fase gas del flusso di fase mobile proveniente dalla colonna contenente gli analiti.
b variazione di segnale generata da una determinata variazione di concentrazione di analita, definita anche come la pendenza della curva di taratura per quell’analita.
c metodologia di preparazione del campione basato sull’interazione degli analiti da estrarre, disciolti in un campione liquido con una fase solida detta adsorbente. La SPE sfrutta le stesse interazioni analita-fase stazionaria che si ritrovano in HPLC.
Riferimenti
(1) Renner, B. J.; Thomas, S. L.; Opetov, M.; Mar, K.; Toma, R.; Rai, A. J.; Schug, K. A. Solid Phase Extraction as Sample Pretreatment Method for Top-down Quantitative Analysis of Low Molecular Weight Proteins from Biological Samples Using Liquid Chromatography – Triple Quadrupole Mass Spectrometry. Anal. Chim. Acta 2023, 1243 (September 2022). https://doi.org/10.1016/j.aca.2023.340801
(2) Cheon, D. H.; Nam, E. J.; Park, K. H.; Woo, S. J.; Lee, H. J.; Kim, H. C.; Yang, E. G.; Lee, C.; Lee, J. E. Comprehensive Analysis of Low-Molecular-Weight Human Plasma Proteome Using Top-Down Mass Spectrometry. 2016. https://doi.org/10.1021/acs.jproteome.5b00773
(3) Thomas, S. L.; Thacker, J. B.; Schug, K. A.; Maráková, K. Sample Preparation and Fractionation Techniques for Intact Proteins for Mass Spectrometric Analysis. J. Sep. Sci. 2021, 44 (1), 211–246. https://doi.org/10.1002/jssc.202000936
(4) Volpe, M.; Carnovali, M.; Mastromarino, V. The Natriuretic Peptides System in the Pathophysiology of Heart Failure: From Molecular Basis to Treatment. Clin. Sci. 2016, 130 (2), 57–77. https://doi.org/10.1042/CS20150469
(5) Goetze, J. P.; Bruneau, B. G.; Ramos, H. R.; Ogawa, T.; de Bold, M. K.; de Bold, A. J. Cardiac Natriuretic Peptides. Nat. Rev. Cardiol. 2020, 17 (11), 698–717. https://doi.org/10.1038/s41569-020-0381-0
(6) Clerico, A.; Passino, C.; Franzini, M.; Emdin, M. Natriuretic Peptides as Biomarkers of Cardiac Endocrine Function in Heart Failure: New Challenges and Perspectives. Future Cardiol. 2016, 12 (5), 573–584. https://doi.org/10.2217/fca-2016-0013
(7) McDonagh et al,. 2021 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure. Eur. Heart J. 2021, 42 (36), 3599–3726. https://doi.org/10.1093/eurheartj/ehab368
(8) Semenov, A. G.; Katrukha, A. G. Analytical Issues with Natriuretic Peptides - Has This Been Overly Simplified? Ejifcc 2016, 27 (3), 189–207.
(9) Vasile, V. C.; Jaffe, A. S. Natriuretic Peptides and Analytical Barriers. Clin. Chem. 2017, 63 (1), 50–58. https://doi.org/10.1373/clinchem.2016.254714
(10) Carr, D. The Handbook of Analysis and Purification of Peptides and Proteins by Reversed-Phase HPLC. [Online] 2002, Third Edit. https://doi.org/10.1109/MAP.1972.27137
(11) Abaye, D. A.; Agbo, I. A.; Nielsen, B. V. Current Perspectives on Supercharging Reagents in Electrospray Ionization Mass Spectrometry. RSC Adv. 2021, 11 (33), 20355–20369. https://doi.org/10.1039/d1ra00745a
(12) Ewles, M.; Goodwin, L. Bioanalytical Approaches to Analyzing Peptides and Proteins by LC-MS/MS. Bioanalysis 2011, 3 (12), 1379–1397. https://doi.org/10.4155/bio.11.112
(13) Guan, Z.; Yates, N. A.; Bakhtiar, R. Detection and Characterization of Methionine Oxidation in Peptides by Collision-Induced Dissociation and Electron Capture Dissociation. J. Am. Soc. Mass Spectrom. 2003, 14 (6), 605–613. https://doi.org/10.1016/S1044-0305(03)00201-0.
(14) Wingfield, P. T. Protein Precipitation Using Ammonium Sulfate. Curr. Protoc. Protein Sci. 2016, 2016 (April), A.3F.1-A.3F.9. https://doi.org/10.1002/0471140864.psa03fs84



