Articolo divulgativo di Simona Braccini Gli idrogel sono materiali che fanno parte della nostra quotidianità, molto spesso li utilizziamo senza saperlo basti pensare alle lenti a contatto o a numerosi prodotti farmaceutici. Ma grazie alle loro peculiari caratteristiche sono soggetti a molteplici studi per poter ampliare le loro funzioni che fino a pochi anni fa non avremmo mai immaginato che potessero essere in grado di svolgere. Questo breve articolo si concentrerà sugli idrogel e sul loro utilizzo come supporti tridimensionali (scaffold) che garantiscono proprietà fisiche simili ai tessuti molli e un microambiente tridimensionale (3D) adatto per la crescita cellulare in vitro di tumore ovarico.
Gli idrogel sono materiali che fanno parte della nostra quotidianità, molto spesso li utilizziamo senza saperlo basti pensare alle lenti a contatto o a numerosi prodotti farmaceutici. Ma grazie alle loro peculiari caratteristiche sono soggetti a molteplici studi per poter ampliare le loro funzioni che fino a pochi anni fa non avremmo mai immaginato che potessero essere in grado di svolgere. Questo breve articolo si concentrerà sugli idrogel e sul loro utilizzo come supporti tridimensionali (scaffold) che garantiscono proprietà fisiche simili ai tessuti molli e un microambiente tridimensionale (3D) adatto per la crescita cellulare in vitro di tumore ovarico.
Introduzione
Il tumore ovarico cresce e interagisce costantemente con un microambiente complesso formato da cellule immunitarie, fibroblasti, vasi sanguigni, molecole segnale e matrice extracellulare (ECM). Questo ambiente eterogeneo fornisce supporto strutturale e biochimico alle cellule limitrofe e subisce un rimodellamento costante e dinamico che promuove attivamente l'inizio, la crescita e le metastasi del tumore. Nonostante i tradizionali sistemi di coltura cellulare 2D abbiano portato a importanti progressi medici nella ricerca sul cancro, i modelli di coltura cellulare 3D potrebbero aprire nuove possibilità per lo sviluppo di un microambiente tumorale in vitro che riproduce più fedelmente quello osservato negli studi su modelli animali in vivo. La crescente connessione della scienza e della tecnologia dei materiali con la ricerca sul cancro ha consentito progressi significativi nello studio della progressione dei tumori e nello screening dei farmaci, attraverso lo sviluppo di modelli 3D basati su scaffold, a base di idrogel polimerici, che presentano caratteristiche paragonabili a quelle del tessuto di tumore ovarico (1).
Idrogel
Gli idrogel sono reti polimeriche insolubili in acqua organizzate in strutture 3D, in grado di assorbire ingenti quantità di acqua o fluidi biologici grazie alla presenza di gruppi funzionali idrofili nella loro struttura (2).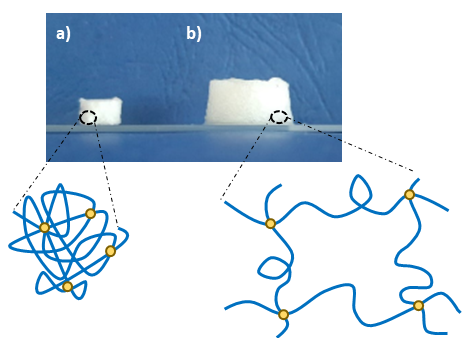
Figura 1: Idrogel a base di chitosano a) allo stato disidratato e b) dopo incubazione in ambiente acquoso.
Tra i gruppi funzionali idrofili nelle catene polimeriche che costituiscono gli idrogel, possiamo citare i gruppi ossidrile (OH-), carbossile (COOH-), ammina (NH2) e solfato (SO3H-) (3). Questi materiali allo stato idratato rigonfiano, diventando morbidi al tatto, e consentono la libera diffusione di nutrienti, ossigeno e prodotti di scarto cellulari, rendendoli adatti per applicazioni biomediche (4). Ad esempio, possono essere impiegati per supportare la rigenerazione di vari tessuti (come cartilagine, osso e tessuti vascolari), per il rilascio di agenti terapeutici (proteine, farmacie geni) e nelle medicazioni (3).
Meccanismi di formazione degli Idrogel
La rete di catene polimeriche idrofile può essere formata tramite vari metodi di reticolazione basati su strategie fisiche o chimiche (1). Gli idrogel fisicamente reticolati si basano su interazioni non covalenti solitamente reversibili (ad esempio interazioni ioniche, elettrostatiche e idrofobiche). Questa strategia di reticolazione è in genere preferita per applicazioni biomediche, grazie alla maggiore sicurezza e semplicità nel preparare gli idrogel e alla minore citotossicità, correlata all'assenza di agenti reticolanti chimici non reagiti. Le strategie di reticolazione fisica includono: interazioni ioniche, metodi dipendenti dalla variazione di temperatura e di pH (5). D'altra parte, gli idrogel chimicamente reticolati possono fornire migliori proprietà meccaniche e una migliore stabilità strutturale in ambiente fisiologico, a causa della formazione di legami covalenti irreversibili. La loro formazione comporta tipicamente la polimerizzazione dei radicali liberi indotta dalla luce (ad esempio, fotopolimerizzazione), l’utilizzo di iniziatori chimici o agenti reticolanti (5).
Tipologie di Idrogel
Gli idrogel si dividono in due categorie a seconda del tipo di polimero da cui sono costituiti: idrogel naturali e sintetici (1). I polimeri naturali e sintetici utilizzati per produrre gli idrogel devono essere biocompatibili, biodegradabili e in alcune applicazioni in cui l'idrogel è a contatto con il sangue devono essere emocompatibili. Un'ampia gamma di idrogel polimerici è stata studiata per supportare la coltura 3D di cellule di tumore ovarico. In particolare, idrogel costituiti da polimeri di origine naturale, come polisaccaridi (es. chitosano, cellulosa, alginato o agarosio) e proteine (es. collagene o gelatina), mostrano un'elevata biocompatibilità, con una chimica superficiale che promuove l'adesione cellulare. D'altra parte, quelli costituiti da polimeri di origine sintetica, come il polietilenglicole (PEG) e la proteina RADA16-I consentono la produzione di scaffold con proprietà meccaniche e degradazione più regolabili ma possono presentare una ridotta capacità di interagire con i tessuti cellulari (6-8).
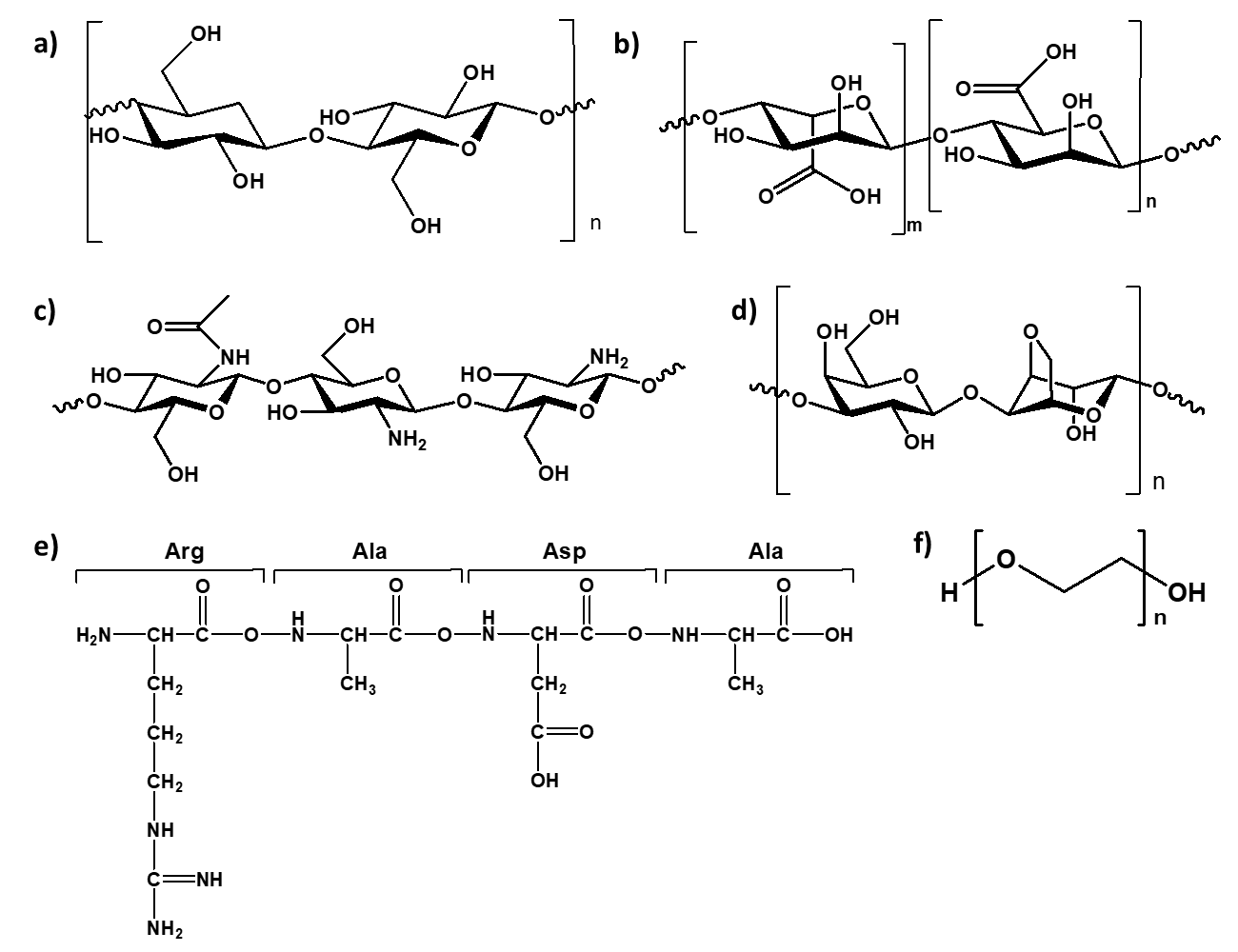
Figura 2: Alcuni dei principali polimeri naturali (a-d) e sintetici (e-f) studiati per la modellazione 3D di tumore ovarico in vitro: a) cellulosa, b) alginato, c) chitosano, d) agarosio, e) RADA16-I e f) polietilenglicole.
Idrogel nelle colture cellulari 3D
Grazie alla loro semplicità, economicità e riproducibilità, le colture cellulari 2D vengono abitualmente impiegate per studiare la biologia e la fisiologia cellulare, la morfologia dei tessuti, l'azione dei farmaci, il processo e lo sviluppo delle malattie. Anche se hanno consentito di comprendere gli aspetti di base della biologia tumorale, queste tecniche di coltura cellulare presentano numerosi svantaggi, principalmente legati alla scarsa fedeltà e realisticità nel rappresentare il microambiente tumorale, che possiede un ruolo di rilievo nella formazione del tumore, nella velocità di proliferazione, quiescenza e formazione di metastasi (9). L'obiettivo dei modelli tumorali 3D è di ridurre il divario tra la coltura cellulare 2D in vitro e i modelli animali. Infatti i sistemi 3D imitano in modo più accurato le complesse interazioni cellula-cellula e cellula-ECM, consentendo una migliore conservazione della morfologia cellulare e dell'eterogeneità che caratterizza i tessuti fisiologici. Questo è un requisito fondamentale poiché sia la morfologia che le interazioni cellula-ambiente influenzano fortemente il comportamento cellulare e le reti di segnalazione intercellulare (10). Studi recenti hanno evidenziato che l’utilizzo di scaffold a base di idrogel per colture 3D in vitro di cellule di tumore ovarico rappresenta un’innovativa ed efficace strategia per ottenere in vitro caratteristiche strutturali e funzionali di tale tessuto. In particolare, gli idrogel possono fornire un substrato adatto alla proliferazione cellulare e proprietà meccaniche paragonabili a quella del tessuto molle ovarico (1). Inoltre il crescente interesse per questa tipologia di coltura cellulare sta portando alla creazione di scaffold a base di idrogel attraverso l’utilizzo di tecniche di stampa 3D, basate su un processo di progettazione e produzione assistito da computer per la fabbricazione strato su strato di oggetti 3D con un alto livello di riproducibilità, controllo avanzato della forma, della geometria e della dimensione dei pori (11).
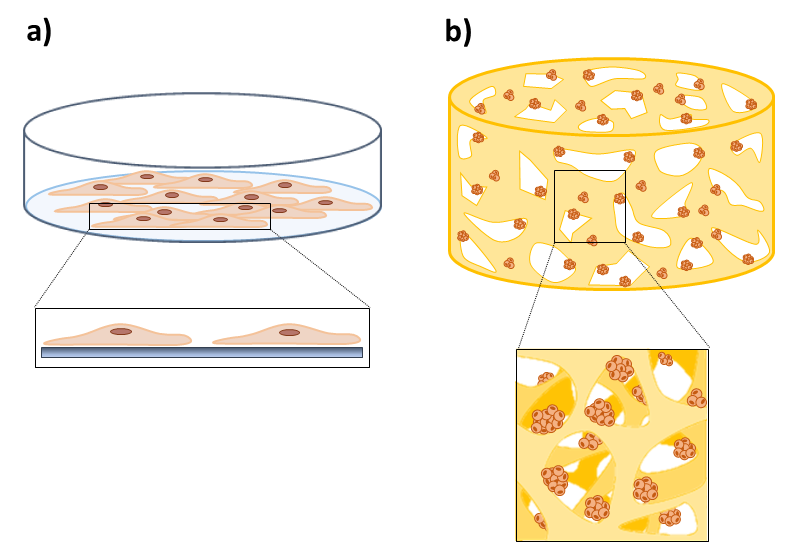
Figura 3: (a) Coltura cellulare 2D: cellule coltivante in un monostrato che non rappresenta in maniera fedele la morfologia tumorale in vivo. (b) Coltura cellulare 3D: nel microambiente 3D, le cellule formano aggregati multicellulari, presentando una morfologia e un comportamento più rappresentativi dei sistemi in vivo.
Conclusioni
Nel prossimo futuro, la ricerca interdisciplinare, i continui e costanti progressi tecnologici e ingegneristici, nonché l'uso di idrogel saranno sicuramente in prima linea nella fabbricazione di un modello in vitro di tumore ovarico biologicamente funzionale da impiegare per lo sviluppo di nuove strategie terapeutiche, che permetterebbero di ottenere importanti informazioni su questa patologia, andando a “Rimpiazzare, Ridurre e Raffinare” l’uso di animali nella sperimentazione scientifica.
Ringraziamenti
Un sentito ringraziamento alla Prof.ssa Federica Chiellini, un esempio di duro lavoro, determinazione e passione. Le siamo grati per tutto quello che ha fatto nel mondo della ricerca al Dipartimento di Chimica e Chimica Industriale dell’Università di Pisa, in particolare nel BIOlab Research Group dove era coordinatrice.
Riferimenti
(1) Braccini, S.; Tacchini, C.; Chiellini, F.; Puppi, D. Polymeric Hydrogels for In Vitro 3D Ovarian Cancer Modeling. Int. J. Mol. Sci. 2022, 23, 3265.
(2) Enas, M. A. Hydrogel: Preparation, characterization, and applications: A review. J. Adv. Res. 2015, 6(2), 105-121.
(3) Chamkouri, H.; Chamkouri, M. A Review of Hydrogels, Their Properties and Applications in Medicine. Am. J. Biomed. Sci. & Res. 2021, 11(6), 485-493.
(4) Carletti, E.; Motta, A.; Migliaresi, C. Scaffolds for Tissue Engineering and 3D Cell Culture. In 3D Cell Culture: Methods and Protocols; Haycock, J.W., Ed.; Humana Press: Totowa, NJ, USA, 2011, pp. 17–39.
(5) Tibbitt, M.W.; Anseth, K.S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol. Bioeng. 2009, 103, 655–663.
(6) Nii, T.; Makino, K.; Tabata, Y. Three-Dimensional Culture System of Cancer Cells Combined with Biomaterials for Drug Screening. Cancers. 2020, 12, 2754.
(7) Keane, T.J.; Badylak, S.F. Biomaterials for tissue engineering applications. Semin. Pediatr. Surg. 2014, 23, 112–118.
(8) Puppi, D.; Chiellini, F. Biodegradable Polymers for Biomedical Additive Manufacturing. Appl. Mater. Today. 2020, 20, 100700.
(9) Klinghammer, K.;Walther,W.; Hoffmann, J. Choosing wisely—Preclinical test models in the era of precision medicine. Cancer Treat. Rev. 2017, 55, 36–45.
(10) Yang, Z.; Xu, H.; Zhao, X. Designer Self-Assembling Peptide Hydrogels to Engineer 3D Cell Microenvironments for Cell Constructs Formation and Precise Oncology Remodeling in Ovarian Cancer. Adv. Sci. 2020, 7, 1903718.
(11) Puppi, D.; Migone, C.; Morelli, A.; Bartoli, C.; Gazzarri, M.; Pasini, D.; Chiellini, F. Microstructured chitosan/poly(Y-glutamic acid) polyelectrolyte complex hydrogels by computer-aided wet-spinning for biomedical three-dimensional scaffolds. J. Bioact. Compat. Polym. 2016, 31, 531–549.



